Что происходит в растворе при прохождении электрического тока? Как связано электричество с веществом? Почему при электрохимическом разложении воды водород и кислород выделяются на разных полюсах?
Многие из этих вопросов суждено было решить великому английскому физику и химику Майклу Фарадею. Он прежде всего выяснил, имеет ли электричество, полученное от разных источников, одну и ту же природу. Учёный установил, что электричество, возникающее при трении веществ (например, в электрофорной машине), а также полученное в гальванической батарее, магнитоэлектричество, «животное» электричество (например, от электрического ската), термоэлектричество тождественны по своей природе и различаются лишь количественно — мощностью и напряжением.
Фарадей придумал для новой науки исключительно удачные термины. Согласно Фарадею, процессы элек
трохимического разложения — электролиза — протекают на электродах (от греч. «электрон» и «ходос» — «дорога», «путь»), В растворе электричество переносится ионами (от греч. «ион» — «идущий»): ионы, несущие положительный заряд (катионы), перемещаются к отрицательно заряженному электроду — катоду (от греч. «катод» — «путь вниз»), а ионы, несущие отрицательный заряд (анионы), направляются к положительно заряженному электроду — аноду (от греч. «анод» — «путь вверх»).
Пользуясь терминологией Фарадея, процесс электролиза расплава поваренной соли NaCl можно представить так Находящиеся в расплаве ионы Na+ и Сl- перемещаются, соответственно, к аноду и катоду. На аноде ионы Сl- отдают свои электроны и переходят в газообразный хлор. На катоде ионы Na+ получают электроны и превращаются в металлический натрий.
Основной заслугой Фарадея, обессмертившей его имя, было установление связи между количеством пропущенного электричества и количеством выделившегося вещества. Учёный доказал, что при электролизе воды объёмы образовавшихся газов — водорода и кислорода — прямо пропорциональны количеству пропущенного электричества и не зависят ни от напряжения, ни от расположения электродов в ванне и их размера, ни от состава раствора (если, конечно, разлагается вода, а не растворённое в ней вещество). Фарадей отметил, что эта зависимость соблюдается столь строго и точно, что по объёму выделившегося газа можно судить о количестве пропущенного электричества. Понимая, насколько важна обнаруженная им зависимость, Фарадей проверил её универсальность и убедился, что она сохраняется и при выделении галогенов. Поэтому свой вывод учёный распространил на все случаи электролиза.
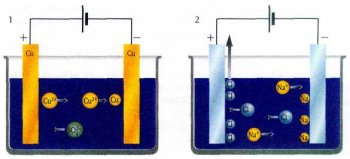
1 — электролиз раствора CuSO4 с медными электродами. На катоде происходит выделение меди, а материал анода растворяется.
2 — электролиз расплава NaCl. На катоде выделяется натрий, а на аноде — хлор.
Затем Фарадей поставил следующий важный вопрос: в каком соотношении выделяются разные вещества при пропускании одного и того же количества электричества? Учёный ответил на него с большим экспериментальным изяществом. Он соединил последовательно несколько ванн с разными разлагающимися веществами (растворами иодида калия, соляной и серной кислот, расплавленными иодидом и хлоридом свинца), некоторое время пропускал через них ток и затем определил массовое соотношение выделившихся веществ. Результат получился удивительный, заранее непредсказуемый: массы выделившихся водорода, кислорода, хлора, иода и свинца относились как 1:8: 36 : 125: 104, т. е. так же, как и их атомные массы, делённые на число валентных электронов. Исходя из этого, Фарадей сформулировал основной закон электролиза:
Количество выделившегося при электролизе вещества пропорционально количеству пропущенного электричества и атомной массе с учётом валентности.
Лаборатория М. Фарадея. Гравюра.
Значение этого закона, совершенно чётко связывающего электричество с химическими свойствами веществ, трудно переоценить. Известный английский электрохимик, сконструировавший один из первых гальванических элементов длительного действия, Джон Фредерик Даниэль (1790—1845) в 1836 г. писал Фарадею: «Ваши открытия в области электрохимии представляют собой одну из самых больших революций в химии и открывают эру новых исследований».

Похожие статьи