Физико – химические свойства белков.
Молекулярная масса. Молекулярная масса белков превышает 6000 Да (до сотен
тысяч и даже несколько миллионов) , например – альбумины – ок.70000, глобулины 150000. Полимеры аминокислот с массой менее 6000 называют пептидами.
Методы определения молекулярной массы белков: ультрацентрифугирование, гельфильтрация, аминокислотный анализ.
Амфотерность. В составе боковых цепей белковой молекулы имеется много групп – COOH и –NH2, которые обеспечивают возникновение положительных и отрицательных зарядов. Поэтому белки являются полиамфионами. Большинство белков заряжены отрицательно (), потому что в их составе преобладают остатки кислых аминокислот Глу и Асп. Катионными (положительно заряженными) являются белки ядра клетки, например, гистоны и протамины, в их составе преобладают аминокислоты Лиз и Арг.
Молекулярная масса. Молекулярная масса белков превышает 6000 Да (до сотен
тысяч и даже несколько миллионов) , например – альбумины – ок.70000, глобулины 150000. Полимеры аминокислот с массой менее 6000 называют пептидами.
Методы определения молекулярной массы белков: ультрацентрифугирование, гельфильтрация, аминокислотный анализ.
Амфотерность. В составе боковых цепей белковой молекулы имеется много групп – COOH и –NH2, которые обеспечивают возникновение положительных и отрицательных зарядов. Поэтому белки являются полиамфионами. Большинство белков заряжены отрицательно (), потому что в их составе преобладают остатки кислых аминокислот Глу и Асп. Катионными (положительно заряженными) являются белки ядра клетки, например, гистоны и протамины, в их составе преобладают аминокислоты Лиз и Арг.
Выделение белков:
Из ткани: гомогенизация (разрушение тканей и клеточных структур)
Из плазмы крови, мочи и др. биологических жидкостей гомогенизация не нужна
– осаждение белков (солями, спиртом или дегидратирующими растворами)
– фракционирование белков (ионообменная или гельпроникающая хроматография) Очистка. Существует много методов, рассмотрим детально гельфильтрацию и диализ.
Разделение белков по молекулярной массе (метод молекулярных сит) или отделение белков от низкомолекулярных веществ обычно ведут при помощи гельфильтрации. При гельфильтрации первыми из колонки выходят белки (или вещества) с большей молекулярной массой, которые не заходят в середину гранул, а позже из колонки выходят вещества з небольшой молекулярной массой, которые застревают в порах геля.
Из ткани: гомогенизация (разрушение тканей и клеточных структур)
Из плазмы крови, мочи и др. биологических жидкостей гомогенизация не нужна
– осаждение белков (солями, спиртом или дегидратирующими растворами)
– фракционирование белков (ионообменная или гельпроникающая хроматография) Очистка. Существует много методов, рассмотрим детально гельфильтрацию и диализ.
Разделение белков по молекулярной массе (метод молекулярных сит) или отделение белков от низкомолекулярных веществ обычно ведут при помощи гельфильтрации. При гельфильтрации первыми из колонки выходят белки (или вещества) с большей молекулярной массой, которые не заходят в середину гранул, а позже из колонки выходят вещества з небольшой молекулярной массой, которые застревают в порах геля.
ПРОСТЫЕ БЕЛКИ – это биополимеры, которые построены из остатков аминокислот, соединенных между собой пептидной связью.
Наука которая изучает строение и функции белков называет протеомикой.
Функции белков. Белки выполняют в организме большинство функций и с ними связаны практически все проявления жизни. Белки делят на такие группы:
1. Каталитические белки. Это специализованный класс белков – ферменты.
2. Сократительные белки. Выполняют функцию движения ( актин и миозин).
3. Защитные белки (антитела, другие антимикробные факторы; защита от кровопотери –фибриноген, факторы свертывания крови т.д.)
4. Регуляторные белки. Сигнальные белки и олигопептиды, гормоны, рецепторы и т.д.
5. Транспортные белки (транспорт веществ в крови, через мембраны). Сейчас известно свыше 6 тысяч транспортных белков.
6. Структурные белки – мембраные, соединительной ткани (коллаген, эластин т.д.), волос (α– кератин) т.д.
7. Пищевые – содержатся в продуктах питания.
8. Запасные и т.д.
Наука которая изучает строение и функции белков называет протеомикой.
Функции белков. Белки выполняют в организме большинство функций и с ними связаны практически все проявления жизни. Белки делят на такие группы:
1. Каталитические белки. Это специализованный класс белков – ферменты.
2. Сократительные белки. Выполняют функцию движения ( актин и миозин).
3. Защитные белки (антитела, другие антимикробные факторы; защита от кровопотери –фибриноген, факторы свертывания крови т.д.)
4. Регуляторные белки. Сигнальные белки и олигопептиды, гормоны, рецепторы и т.д.
5. Транспортные белки (транспорт веществ в крови, через мембраны). Сейчас известно свыше 6 тысяч транспортных белков.
6. Структурные белки – мембраные, соединительной ткани (коллаген, эластин т.д.), волос (α– кератин) т.д.
7. Пищевые – содержатся в продуктах питания.
8. Запасные и т.д.
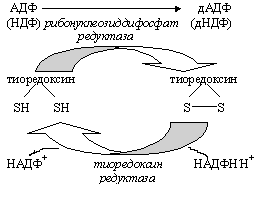
Образование дезоксирибонуклеотидов, необходимых для биосинтеза ДНК, происходит на уровне нуклеозиддифосфатов. С участием специального белка тиоредоксина фермент редуктаза восстанавливает 2/-ОН группу в рибозе и образуется дезоксирибоза. Затем:
дНДФ дНТФ синтез ДНК.
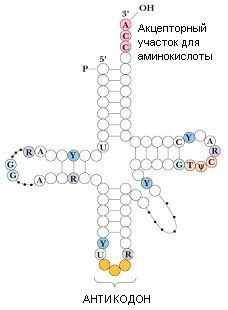
Отличия от ДНК: по локализации (цитоплазма), по функциям (обеспечивает биосинтез белка), по размерам, по строению (содержит У вместо Т, сахар — рибоза). РНК бывает нескольких типов — иРНК, рРНК, тРНК, гяРНК (гетерогенная ядерная РНК), мяРНК (малая ядерная РНК).
Вторичная структура — всегда одна цепь (у тРНК —
«лист клевера»).
Третичная структура — у тРНК формируется самостоятельно и похожа на объемную букву L; у рРНК и иРНК образуется в связи с белками (рРНК+белок = рибосома, иРНК+белок = информосома).
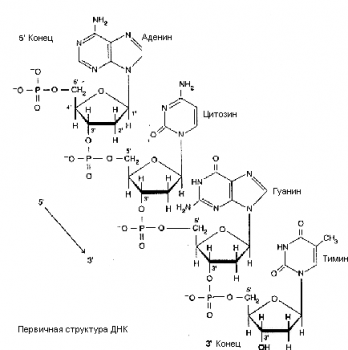
В ДНК входят 4 типа АО: А, Т, Г, Ц; сахар дезоксирибоза. Связь между нуклеотидами образуется с участием 3/-ОН-группы
одного нуклеотида и 5/-остатком фосфорной кислоты другого (3/–5/- фосфодиэфирная связь). В результате молекула полинуклеотида приобретает направленность — у нее есть 3/-конец и
5/-конец.
Под первичной структурой ДНК понимают последовательность нуклеотидов в одной полинуклеотидной цепи.
Вторичная структура ДНК (1953 г., Д. Уотсон, Ф. Крик) — двойная спираль, построенная по принципам комплементарности (А — Т, Г — Ц) и антипараллельности (3/-концу одной цепи соответствует 5/-конец другой).
Силы, стабилизирующие двойную спираль: 1) горизонтальные водородные связи между АО (А = Т, Г ≡ Ц); 2)
вертикальные «стейкинг»-взаимодействия между АО; 3) гидрофобные взаимодействия (АО обращены внутрь, к оси спирали, а полярные пентозы и фосфаты — наружу).
Окисление жирных кислот в пероксисомах составляет около 30 % всего их окисления. В пероксисомах окисляются необычные жирные кислоты (с длинной углеводородной цепью, дикарбоновые, с разветвленным радикалом). Укорочение радикала в пероксисомах происходит до тех пор, пока не образуется ацил-КоА со средней длиной цепи. Образующийся ацил-КоА с С-8 впоследствии подвергается дальнейшему окислению в митохондриях.
Первоначальная стадия дегидрирования в ходе пероксисомального окисления жирных кислот протекает с образованием Н2О2, а не ФАДН2. Перекись водорода удаляется с помощью каталазы. Все последующие реакции аналогичны происходящим в митохондриях, хотя катализируются они изоферментами пероксисом.
Первоначальная стадия дегидрирования в ходе пероксисомального окисления жирных кислот протекает с образованием Н2О2, а не ФАДН2. Перекись водорода удаляется с помощью каталазы. Все последующие реакции аналогичны происходящим в митохондриях, хотя катализируются они изоферментами пероксисом.
Состав липопротеинов. Липопротеины состоят из ядра, в котором находятся триацилглицеролы (ТАГ), эфиры холестерола (ЭХ), и поверхностного монослоя из фосфолипидов (ФЛ), свободного или неэстерифицированного холестерола (СХ) и апопротеинов. Функцией липопротеинов является транспорт липидов. Без этой транспортной формы липиды были бы нерастворимы в плазме крови.
Синтез хиломикронов (ХМ). В клетках слизистой кишечника (энтероцитах) идет эстерификация 2-МАГ и ХС жирными кислотами (ЖК), образуются ТАГ и ЭХ, из которых затем формируются ХМ. Всосавшиеся ЖК активируются, преобразуясь в ацил-КоА. Это происходит в гладком ЭР. Важнейшим структурным компонентом ХМ является белок (апо В-48). В составе одной частицы ХМ находится одна молекула апо В-48.
ХМ секретируются с базолатеральной поверхности клеток кишечника в лимфу, а оттуда, через грудной лимфатический проток, попадают в систему кровообращения. После того как ХМ попадают в лимфу, они получают от ЛПВП апо С-II, С-III и апо Е.
Синтез хиломикронов (ХМ). В клетках слизистой кишечника (энтероцитах) идет эстерификация 2-МАГ и ХС жирными кислотами (ЖК), образуются ТАГ и ЭХ, из которых затем формируются ХМ. Всосавшиеся ЖК активируются, преобразуясь в ацил-КоА. Это происходит в гладком ЭР. Важнейшим структурным компонентом ХМ является белок (апо В-48). В составе одной частицы ХМ находится одна молекула апо В-48.
ХМ секретируются с базолатеральной поверхности клеток кишечника в лимфу, а оттуда, через грудной лимфатический проток, попадают в систему кровообращения. После того как ХМ попадают в лимфу, они получают от ЛПВП апо С-II, С-III и апо Е.
Глюкуроновый путь («Путь уроновых кислот») осуществляется в печени и в клетках соединительной ткани. Первая часть процесса (до образования УДФ-глюкозы) совпадает с реакциями синтеза гликогена, заключительный этап (от ксилулозо-5-ф до гл-6-ф) совпадает с неокислительным этапом ПФП
Значение глюкуронового пути:
1.Образование активированного глюкуроната.
В гепатоцитах УДФ-глюкуроновая кислота используется на процессы обезвреживания
(реакции конъюгации с билирубином, продуктами гниения белков, лекарствами и др.).
В фибробластах УДФ-глюкуроновая кислота используется на синтез гетерополи- сахаридов (гиалуроновая кислота, хондроитинсульфат, дерматансульфат, гепарин).
Значение глюкуронового пути:
1.Образование активированного глюкуроната.
В гепатоцитах УДФ-глюкуроновая кислота используется на процессы обезвреживания
(реакции конъюгации с билирубином, продуктами гниения белков, лекарствами и др.).
В фибробластах УДФ-глюкуроновая кислота используется на синтез гетерополи- сахаридов (гиалуроновая кислота, хондроитинсульфат, дерматансульфат, гепарин).
Пентозофосфатный путь (ПФП) обмена углеводов нередко называют апотомическим путём, так как обмен глюкозы идёт по первому (С1) атому углерода.
Доля ПФП в количественном превращении глюкозы в клетках обычно невелика (в
большинстве клеток не более 10 %) и варьирует в зависимости от типа ткани и её функ- ционального состояния. Так, в клетках печени по этому пути превращается до 20 % глюкозы, в эритроцитах — 7 %, в клетках мозга — около 2 %. Этот процесс идет в клетках многих органов и тканей.
Ферменты ПФП локализованы в цитоплазме клеток.
Превращение глюкозы по ПФП не требует присутствия кислорода. Если по ПФП
превращается шесть молекул Гл-6-Ф, то за один цикл молекула Гл-6-Ф катаболизирует до 6 СО2.
Доля ПФП в количественном превращении глюкозы в клетках обычно невелика (в
большинстве клеток не более 10 %) и варьирует в зависимости от типа ткани и её функ- ционального состояния. Так, в клетках печени по этому пути превращается до 20 % глюкозы, в эритроцитах — 7 %, в клетках мозга — около 2 %. Этот процесс идет в клетках многих органов и тканей.
Ферменты ПФП локализованы в цитоплазме клеток.
Превращение глюкозы по ПФП не требует присутствия кислорода. Если по ПФП
превращается шесть молекул Гл-6-Ф, то за один цикл молекула Гл-6-Ф катаболизирует до 6 СО2.
Глюконеогенез — синтез глюкозы из соединений неуглеводной природы.
В организме взрослого человека за сутки может синтезироваться до 250 г глюкозы. Глюконеогенез осуществляется главным образом в печени (синтезируетя до 90 % всей глюкозы), в корковом веществе почек и в энтероцитах (совсем незначительно).
Глюконеогенез стимулируется при длительном голодании, при ограничении поступления углеводов с пищей, в период восстановления после мышечной нагрузки, у новорождённых в первые часы после рождения.
Субстраты глюконеогенеза. Истинными субстратами глюконеогенеза являютя пируват, оксалоацетат, фосфодиоксиацетон, которые непосредственно включаются в этот процесс. Все вещества неуглеводной природы, дающие эти метаболиты, являются субстратами глюконеогенеза: лактат→ПВК, метаболиты цикла Кребса→ЩУК, глицерол→фосфодиоксиацетон, пропионил-КоА→метаболиты цикла Кребса→ЩУК, глюкогенные аминокислоты→ПВК или ЩУК. Главный источник субстратов глюконеогенеза — глюкогенные аминокислоты. К глюкогенным аминокислотам относятся все протеиногенные аминокислоты, кроме лейцина и лизина.
В организме взрослого человека за сутки может синтезироваться до 250 г глюкозы. Глюконеогенез осуществляется главным образом в печени (синтезируетя до 90 % всей глюкозы), в корковом веществе почек и в энтероцитах (совсем незначительно).
Глюконеогенез стимулируется при длительном голодании, при ограничении поступления углеводов с пищей, в период восстановления после мышечной нагрузки, у новорождённых в первые часы после рождения.
Субстраты глюконеогенеза. Истинными субстратами глюконеогенеза являютя пируват, оксалоацетат, фосфодиоксиацетон, которые непосредственно включаются в этот процесс. Все вещества неуглеводной природы, дающие эти метаболиты, являются субстратами глюконеогенеза: лактат→ПВК, метаболиты цикла Кребса→ЩУК, глицерол→фосфодиоксиацетон, пропионил-КоА→метаболиты цикла Кребса→ЩУК, глюкогенные аминокислоты→ПВК или ЩУК. Главный источник субстратов глюконеогенеза — глюкогенные аминокислоты. К глюкогенным аминокислотам относятся все протеиногенные аминокислоты, кроме лейцина и лизина.
Гликолиз — это сложный ферментативный процесс расщепления глюкозы до двух молекул пирувата (аэробный гликолиз) или двух молекул лактата (анаэробный гликолиз, протекающий без потребления кислорода).
Суммарное уравнение анаэробного гликолиза:
C6H12O6 + 2АДФ + 2Фн 2CH3CH(OH)COOH + 2АТФ + 2H2O Глюкоза Молочная кислота
Гликолиз функционирует во всех живых клетках. Все ферменты локализованы в цитозоле, формируя полиферментный комплекс.
Гликолиз осуществляется в два этапа.
I. Подготовительный этап — дихотомический распад глюкозы на две молекулы глицеральдегид-3-фосфата. Превращения сопровождаются затратой 2 АТФ.
II. Этап гликолитической оксидоредукции — превращение глицеральдегид-3-фосфата в лактат. Включает окислительно-восстановительные реакции и реакции фосфорилирования, сопровождающиеся генерацией АТФ.
Суммарное уравнение анаэробного гликолиза:
C6H12O6 + 2АДФ + 2Фн 2CH3CH(OH)COOH + 2АТФ + 2H2O Глюкоза Молочная кислота
Гликолиз функционирует во всех живых клетках. Все ферменты локализованы в цитозоле, формируя полиферментный комплекс.
Гликолиз осуществляется в два этапа.
I. Подготовительный этап — дихотомический распад глюкозы на две молекулы глицеральдегид-3-фосфата. Превращения сопровождаются затратой 2 АТФ.
II. Этап гликолитической оксидоредукции — превращение глицеральдегид-3-фосфата в лактат. Включает окислительно-восстановительные реакции и реакции фосфорилирования, сопровождающиеся генерацией АТФ.