Гормоны — это класс регуляторных молекул, синтезируемых специальными клетками.
Особенности биологического действия: 1) низкая концентрация в крови (10–6–10–12 М);
2) обязательная связь с рецептором – (R), включающим каскадный механизм усиления гормонального сигнала; 3) изменение скорости синтеза ферментов или их активности; 4) регуляция секреции по принципу прямой и (или) обратной связи.
Взаимодействие гормона и (R) характеризуется высокой специфичностью, которая обеспечивается комплементарностью между структурой гормона и активного центра (R).
В результате эффекта кооперативности, возникающего при взаимодействии гормона и (R), существенно изменяется активность (R) — это есть феномен амплификации (усиления) гормонального сигнала. Механизм амплификации включает участие специальных ферментов и молекул — вторичных посредников. Гормональный сигнал способен «выключаться» в результате инактивирования (R) путём его фосфорилирования, либо удаления (R) с поверхности клетки (эндоцитоз) и т. д. Множество разных сигналов, воспринимаемых клеткой, суммируется в один определённый ответ.
Особенности биологического действия: 1) низкая концентрация в крови (10–6–10–12 М);
2) обязательная связь с рецептором – (R), включающим каскадный механизм усиления гормонального сигнала; 3) изменение скорости синтеза ферментов или их активности; 4) регуляция секреции по принципу прямой и (или) обратной связи.
Взаимодействие гормона и (R) характеризуется высокой специфичностью, которая обеспечивается комплементарностью между структурой гормона и активного центра (R).
В результате эффекта кооперативности, возникающего при взаимодействии гормона и (R), существенно изменяется активность (R) — это есть феномен амплификации (усиления) гормонального сигнала. Механизм амплификации включает участие специальных ферментов и молекул — вторичных посредников. Гормональный сигнал способен «выключаться» в результате инактивирования (R) путём его фосфорилирования, либо удаления (R) с поверхности клетки (эндоцитоз) и т. д. Множество разных сигналов, воспринимаемых клеткой, суммируется в один определённый ответ.
Фибринолиз — это процесс расщепления фибрина (фибриногена) на растворимые фрагменты (пептиды).
Основным звеном фибринолиза является плазминовая система. В плазминовую систему входят плазмин и его профермент — плазминоген, активаторы плазминогена, проактиваторы плазминогена, ингибиторы плазмина и ингибиторы активаторов плазминогена.
Плазмин обладает высокой специфичностью к фибрину и фибриногену. В результате действия плазмина фибрин (фибриноген) распадается на растворимые фрагменты (продукты деградации фибрина), которые затем удаляются из кровотока ретикулоэндоте-лиальной системой.
В плазме крови содержится плазминоген — неактивный предшественник плазмина.
Плазминоген — гликопротеин, синтезируемый в печени, костном мозге, почках. Превращение плазминогена в плазмин происходит в результате частичного протеолиза под действием активаторов плазминогена.
Активаторы плазминогена (АПГ). Существует большое количество АПГ, которые присутствуют в крови, других биологических жидкостях и тканях организма человека. Физиологические активаторы плазминогена классифицируются в зависимости от источника получения на тканевые (органные), сосудистые (тканевый активатор плазминогена), плазменные, кровяные, активатор из мочи — урокиназа, АПГ, выделяемые культурами раковых и трансформированных онкогенами клеток. Важнейший внешний активатор плазминогена — тканевый активатор плазминогена (тАПГ) — синтезируется эндотелиальными клетками кровеносных сосудов. Практически все АПГ продуцируются в виде проферментов (проактиваторов плазминогена).
Основным звеном фибринолиза является плазминовая система. В плазминовую систему входят плазмин и его профермент — плазминоген, активаторы плазминогена, проактиваторы плазминогена, ингибиторы плазмина и ингибиторы активаторов плазминогена.
Плазмин обладает высокой специфичностью к фибрину и фибриногену. В результате действия плазмина фибрин (фибриноген) распадается на растворимые фрагменты (продукты деградации фибрина), которые затем удаляются из кровотока ретикулоэндоте-лиальной системой.
В плазме крови содержится плазминоген — неактивный предшественник плазмина.
Плазминоген — гликопротеин, синтезируемый в печени, костном мозге, почках. Превращение плазминогена в плазмин происходит в результате частичного протеолиза под действием активаторов плазминогена.
Активаторы плазминогена (АПГ). Существует большое количество АПГ, которые присутствуют в крови, других биологических жидкостях и тканях организма человека. Физиологические активаторы плазминогена классифицируются в зависимости от источника получения на тканевые (органные), сосудистые (тканевый активатор плазминогена), плазменные, кровяные, активатор из мочи — урокиназа, АПГ, выделяемые культурами раковых и трансформированных онкогенами клеток. Важнейший внешний активатор плазминогена — тканевый активатор плазминогена (тАПГ) — синтезируется эндотелиальными клетками кровеносных сосудов. Практически все АПГ продуцируются в виде проферментов (проактиваторов плазминогена).
Антикоагулянтная система — это ряд ингибиторов свёртывания (антикоагулянтов), осуществляющих контроль скорости активирования факторов свёртывания и реакций между ними.
Практически каждому из участников процесса фибринообразования противостоят специфические ингибиторы. Многие антикоагулянты обладают антитромбиновым действием.
По механизму образования в организме все естественные (физиологические) антикоагулянты разделяют на первичные и вторичные. Первичные антикоагулянты постоянно синтезируются и с постоянной скоростью выделяются в кровоток. Первичные антикоагулянты ингибируют активные факторы коагуляции и не действуют на неактивные формы этих факторов. Вторичные антикоагулянты образуются из факторов свёртывания и других белков в процессе свёртывания крови, фибринолиза и активации других протеолитических систем.
Из физиологических антикоагулянтов функционально наиболее значимыми являются антитромбин III, гепарин, протеины С и S, 2-макроглобулин, липопротеин-ассоциированный коагуляционный ингибитор (ЛАКИ).
Практически каждому из участников процесса фибринообразования противостоят специфические ингибиторы. Многие антикоагулянты обладают антитромбиновым действием.
По механизму образования в организме все естественные (физиологические) антикоагулянты разделяют на первичные и вторичные. Первичные антикоагулянты постоянно синтезируются и с постоянной скоростью выделяются в кровоток. Первичные антикоагулянты ингибируют активные факторы коагуляции и не действуют на неактивные формы этих факторов. Вторичные антикоагулянты образуются из факторов свёртывания и других белков в процессе свёртывания крови, фибринолиза и активации других протеолитических систем.
Из физиологических антикоагулянтов функционально наиболее значимыми являются антитромбин III, гепарин, протеины С и S, 2-макроглобулин, липопротеин-ассоциированный коагуляционный ингибитор (ЛАКИ).
Назначение свёртывающей системы крови — образование нерастворимого фибрина. В свёртывающую систему крови входят ферментные и неферментные белки плазмы, тканей и форменных элементов крови (прежде всего тромбоцитов), надмолекулярные образования (фрагменты клеточных мембран) и ионизированный кальций. Международный комитет по выработке номенклатуры факторов свёртывания присвоил арабскую нумерацию тромбоцитарным (P1–11) и римскую (ф.I–XIII) — плазменным и тканевым факторам.
Большинство плазменных факторов гемокоагуляции являются ферментами (сериновые протеиназы), синтезируются в печени и секретируются в кровь в неактивном состоянии, то есть в виде прокоагулянтов. Активирование большинства прокоагулянтов осуществляется путём частичного протеолиза. На определённых этапах процесс свёртывания резко ускоряется неферментными белками (ф.VIII и ф.V), выполняющими роль коферментов.
Свёртывание крови (гемокоагуляция) — цепной каскадный ферментативный процесс, в ходе которого происходит взаимодействие и последовательная активация ряда сериновых протеиназ на фосфолипидных матрицах (тромбопластинах), заканчивающийся превращением растворимого фибриногена в нерастворимый фибрин.
Большинство плазменных факторов гемокоагуляции являются ферментами (сериновые протеиназы), синтезируются в печени и секретируются в кровь в неактивном состоянии, то есть в виде прокоагулянтов. Активирование большинства прокоагулянтов осуществляется путём частичного протеолиза. На определённых этапах процесс свёртывания резко ускоряется неферментными белками (ф.VIII и ф.V), выполняющими роль коферментов.
Свёртывание крови (гемокоагуляция) — цепной каскадный ферментативный процесс, в ходе которого происходит взаимодействие и последовательная активация ряда сериновых протеиназ на фосфолипидных матрицах (тромбопластинах), заканчивающийся превращением растворимого фибриногена в нерастворимый фибрин.
Система свёртывания крови по функциональному признаку делится на две системы: свёртывающую (гемокоагуляционную) и противосвёртывающую (антитромботическую). Противосвёртывающее действие обеспечивается антикоагулянтной и фибринолитической системами. Поддержание жидкого состояния циркулирующей крови обеспечивается взаимодействием свёртывающей и противосвёртывающей систем крови, которые в физиологических условиях находятся в динамическом равновесии.
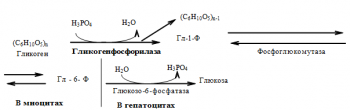
Схема фосфоролиза гликогена
Распад гликогена в мышцах происходит при мышечных сокращениях, а в печени — при голодании и в перерывах между приёмами пищи. Основной механизм гликогенолиза — фосфоролиз (расщепление -1,4-гликозидных связей с участием фосфорной кислоты и гликогенфосфорилазы).
Различия гликогенолиза в печени и мышцах. В гепатоцитах есть фермент глюкозо-6- фосфатаза и образуется свободная глюкоза, которая поступает в кровь. В миоцитах нет глюкозо-6-фосфатазы. Образовавшийся глюкозо-6-фосфат не может выйти из клетки в кровь (фосфорилированная глюкоза не проходит цитоплазматическую мембрану) и используется на нужды миоцитов.
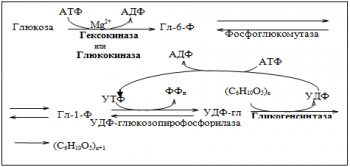
Схема синтеза гликогена
Общее содержание гликогена в организме взрослого человека около 450 г (в печени —
до 150 г, в мышцах — около 300 г). Более интенсивно гликогенез осуществляется в печени.
Гликогенсинтаза — ключевой фермент процесса — катализирует присоединение глюкозы к молекуле гликогена с образованием -1,4-гликозидных связей.
Существует группа белков-переносчиков глюкозы (ГЛЮТ), сходных по структуре, но различающихся по участию в транспорте глюкозы (пять изоформ собственных транспортеров глюкозы). Они локализованы в плазматических мембранах всех клеток и участвуют в транспорте глюкозы (ускоряют транспорт) по градиенту её концентрации.
Инсулин стимулирует поступление глюкозы в адипоциты, миоциты и кардиомиоциты, увеличивая количество ГЛЮТ 4 в плазматических мембранах этих клеток.
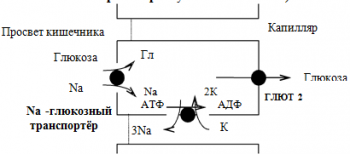
Всасывание глюкозы происходит в два этапа. I этап — транспорт глюкозы из полости тонкого кишечника в энтероциты. Осуществляется по двум механизмам:
натрий-независимый транспорт с участием ГЛЮТ 5;
натрий-зависимый транспорт с участием Na -глюкозного транспортёра.
2 этап — транспорт глюкозы из энтероцитов в капилляры портальной венозной системы (натрий-независимый транспорт с участием ГЛЮТ 2).
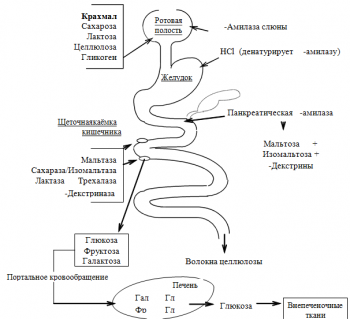
Ротовая полость. -Амилаза слюны гидролизует внутренние -1,4-гликозидные связи. Продуктами пищеварения являются олигосахаридные фрагменты (декстрины), в небольшом количестве — мальтоза и глюкоза.
Тонкий кишечник. Секретин стимулирует выделение панкреатического сока.
Холецистокинин-панкреозимин стимулирует секрецию панкреатической - амилазы и других панкреатических ферментов пищеварения.
Панкреатическая - амилаза гидролизует внутренние - 1,4-гликозидные связи олигосахаридов и полисахаридов до мальтозы, изомальтозы и - декстринов.
Углеводы — альдегиды и кетоны многоатомных спиртов, а также производные и полимеры этих соединений.
Углеводы пищи. Большая часть углеводов поступает в организм с пищей растительного происхождения. Обычный суточный рацион содержит 400–500 г углеводов, из которых 60–80 % составляют полисахариды (в основном крахмал, в меньшем количестве — гликоген и пищевые волокна), 20–30 % олигосахариды (сахароза, лактоза, мальтоза), остальное количество — моносахариды (в основном глюкоза, фруктоза и пентозы). Углеводы обеспечивают 60–70 % (не менее 50 %) суточного энергопотребления. В кишечнике всасываются моносахариды, поэтому в процессе переваривания углеводов пищи должно происходить их расщепление до моносахаридов.
Углеводы пищи. Большая часть углеводов поступает в организм с пищей растительного происхождения. Обычный суточный рацион содержит 400–500 г углеводов, из которых 60–80 % составляют полисахариды (в основном крахмал, в меньшем количестве — гликоген и пищевые волокна), 20–30 % олигосахариды (сахароза, лактоза, мальтоза), остальное количество — моносахариды (в основном глюкоза, фруктоза и пентозы). Углеводы обеспечивают 60–70 % (не менее 50 %) суточного энергопотребления. В кишечнике всасываются моносахариды, поэтому в процессе переваривания углеводов пищи должно происходить их расщепление до моносахаридов.
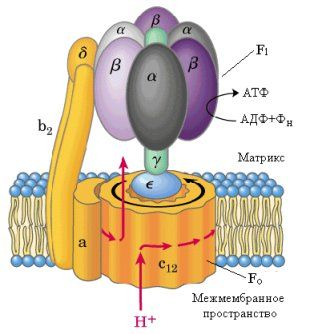
Ι. НАДН-убихинон-оксидоредуктаза. Принимает электроны и протоны от НАДН•Н+;
протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.
Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью.
Ι. НАДН-убихинон-оксидоредуктаза. Принимает электроны и протоны от НАДН•Н+;
протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.
Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью.
протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.
Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью.
Ι. НАДН-убихинон-оксидоредуктаза. Принимает электроны и протоны от НАДН•Н+;
протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.

Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью.