Антитела. В 1959 году ученые Соединенных Штатов Америки Едельман и Портер с сотрудниками начали исследования структуры антител. Работа закончилась расшифровкой структуры иммуноглобулина G (IgG), за что ученым в дальнейшем была присужденна Нобелевская премия. Теперь известно, что все антитела имеют характерную структуру иммуноглобулинов и делятся на 5 классов – ІgG , ІgА, ІgМ, ІgD и ІgЕ. Можно дать такое определение антител. Антитела - это белки иммуноглобулиновой природы, способные специфично реагировать (соединяться) с соответствующим антигеном или гаптеном. В состав молекулы иммуноглобулина любого класса входят так называемые тяжелые (Н) и легкие (L) цепи. Количество этих цепей в молекуле - не меньше двух. Англ. Н (heavy - тяжелый), L (light - легкий).
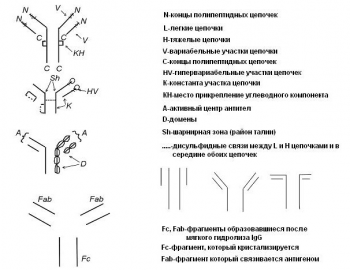
Сначала рассмотрим структуру наиболее распространенного в организме человека иммуноглобулина - IgG. Его концентрация в сыворотке крови может достигать 15 г/л и даже выше. В состав IgG входят две тяжелых и две легких цепи. Каждая цепь имеет С - и N- концы.
В зоне N-концов находится активный центр антител. Тяжелые цепи связаны между собой дисульфидными мостиками. Такие же самые связи имеются между легкими и тяжелыми цепями, а также внутри цепей. К полипептидным Н-цепям присоединены углеводные компоненты. Значит, IgG, как и все другие иммуноглобулины, принадлежит к сложным белкам-гликопротеинам. В каждой цепи есть константная (К) и вариабельная части. В составе вариабельных участков существуют так называемые гипервариабельные зоны. Именно они составляют активный центр антител. Видно, что антитела класса ІgG являются двухвалентными. Иммуноглобулин имеет доменную структуру. Есть шарнирная зона («талия») за счет чего может изменяться угол между условными линиями, которые связывают талию с активными центрами. Зона талии содержит 16-60 аминокислотных остатков и имеет ту особенность, что среди них много остатков пролина. При действии на IgG протеолитических ферментов первой атакуется талия, в результате чего молекула ІgG делится на 3 фрагмента - два фрагмента Fab и один Fc. В состав фрагмента Fc входят лишь константные отрезки тяжелых цепей, в состав Fab фрагментов входит отрезок тяжелой цепи и вся легкая цепь. Fab фрагмент, естественно, сохраняет возможность соединяться с антителом, тогда как фрагмент Fc такого свойства лишен. На поверхности многих клеток: В- лимфоцитов, фагоцитов, гепатоцитов и других расположенны рецепторы для Fс фрагмента ІgG , что указывает на его важное регуляторное значение.
На схеме приведенна структура иммуноголобулина класа М:
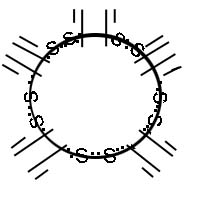
Видно, что молекула ІgM складывается как бы из пяти структур, каждая из которых напоминает IgG. ІgМ имеет 10 валентностей, ему свойственны особые биологические свойства.
В таблице приведенны общие данные о составе, строении и некоторых свойствах иммуноглобулинов. Видно, что все иммуноглобулины имеют специфические, присущие только им тяжелые цепи - γ, µ, α, σ и ε. В IgG, IgМ и IgА имеются подклассы. Легкие цепи во всех иммуноглобулинах подобные, но двух видов: c- или λ. ІgМ является пентамером, олигомером может быть также
ІgА. Наибольшая молекулярная масса у ІgМ - около 900 000. Все Ig содержат углеводный компонент - от 3 до 12% от общей массы. ІgА( а именно секреторный иммуноглобулин) содержит также дополнительный секреторный компонент, с помощью которого он переносится из крови в другие биологические жидкости (слюна, слеза, молоко и прочие) и в слизистые оболочки. Наибольшую способность к связыванию комплемента имеет комплекс антигена с ІgМ и IgG. В крови циркулируют в основном ІgG, IgА(сывороточный) и IgМ, очень мало IgD и IgE. Через плаценту проходит лишь IgG, который во время беременности осуществляет иммунологическую защиту плода.
Биологическое значение каждого иммуноглобулина разное. Наибольшее значение имеет IgG, уровень которого в крови самый высокий, у него же наиболее длинный период полужизни. Во фракции IgG содержится огромное количество антител разнообразной специфичности. В условиях иммунопатологии антитела класса IgG могут вызывать аллергию немедленного типа.
ІgМ имеет свойства опсонинов, то есть реагируя с бактериями ІgМ оказывает содействие их фагоцитозу. К классу ІgМ относятся так называемые «нормальные» (естественные) антитела. В противоположность «иммунным» антителам, они постоянно находятся в крови.
Секреторный ІgА осуществляет, пограничную, барьерную иммунологическую защиту, так как содержится в большом количестве в слизистых оболочках, их секретах и биологических жидкостях ( особенно в молоке). Поэтому ІgА имеет особое значение для детского возраста. Первое молоко матери - молозивное - представляет собой по сути концентрат ІgА. Содержание ІgА в молоке матери после родов постепенно снижается и достигает минимального уровня на 6 месяц лактации. Напомним, что именно в это время в основном завершается формирование собственной системы иммунитета ребенка.
Антитела класса IgD владеют противовирусной активностью. К классу IgD принадлежит часть аутоантител. ІgЕ принадлежат к так называемым «реагинам». Из крови они переходят в ткани, где адсорбируются на поверхности базофилов и других клеток, отвечают за проявление местной аллергии. Одно из направлений лечения аллергии - торможение синтеза ІgЕ.
Все антитела синтезируются плазматическими клетками, которые возникают вследствие дифференциации В-лимфоцитов. Антитела исключительно гетерогенные. Почему? Во-первых потому, что есть два варианта легких цепей и несколько подклассов тяжелых цепей. Во-вторых потому, что есть много клонов плазматических клеток, а клетки каждого клона вырабатывают уникальные по структуре антитела за счет изменений аминокислотной последовательности в вариабельных участках обеих цепей.
Считают, что количество вариантов антител достигает нескольких миллионов. Поскольку количество генов в геноме человека равняется приблизительно 30 тысячам, то возникновение генных локусов для синтеза каждого из миллионов антител можно объяснить лишь процессом рекомбинации генов.
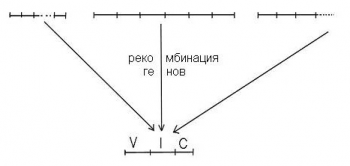
Схема образования генного локуса (для легкой цепи иммуноглобулинов),
который отвечает за синтез легкой цепи иммуноглобулинов (в процессе дифференциации стволовой клетки в В-лимфоцит).
Семейство V ( 500 генов) семейство I (5-6 генов) семейство С (10-20 генов)
Сначала рассмотрим структуру наиболее распространенного в организме человека иммуноглобулина - IgG. Его концентрация в сыворотке крови может достигать 15 г/л и даже выше. В состав IgG входят две тяжелых и две легких цепи. Каждая цепь имеет С - и N- концы.
В зоне N-концов находится активный центр антител. Тяжелые цепи связаны между собой дисульфидными мостиками. Такие же самые связи имеются между легкими и тяжелыми цепями, а также внутри цепей. К полипептидным Н-цепям присоединены углеводные компоненты. Значит, IgG, как и все другие иммуноглобулины, принадлежит к сложным белкам-гликопротеинам. В каждой цепи есть константная (К) и вариабельная части. В составе вариабельных участков существуют так называемые гипервариабельные зоны. Именно они составляют активный центр антител. Видно, что антитела класса ІgG являются двухвалентными. Иммуноглобулин имеет доменную структуру. Есть шарнирная зона («талия») за счет чего может изменяться угол между условными линиями, которые связывают талию с активными центрами. Зона талии содержит 16-60 аминокислотных остатков и имеет ту особенность, что среди них много остатков пролина. При действии на IgG протеолитических ферментов первой атакуется талия, в результате чего молекула ІgG делится на 3 фрагмента - два фрагмента Fab и один Fc. В состав фрагмента Fc входят лишь константные отрезки тяжелых цепей, в состав Fab фрагментов входит отрезок тяжелой цепи и вся легкая цепь. Fab фрагмент, естественно, сохраняет возможность соединяться с антителом, тогда как фрагмент Fc такого свойства лишен. На поверхности многих клеток: В- лимфоцитов, фагоцитов, гепатоцитов и других расположенны рецепторы для Fс фрагмента ІgG , что указывает на его важное регуляторное значение.
На схеме приведенна структура иммуноголобулина класа М:

Видно, что молекула ІgM складывается как бы из пяти структур, каждая из которых напоминает IgG. ІgМ имеет 10 валентностей, ему свойственны особые биологические свойства.
В таблице приведенны общие данные о составе, строении и некоторых свойствах иммуноглобулинов. Видно, что все иммуноглобулины имеют специфические, присущие только им тяжелые цепи - γ, µ, α, σ и ε. В IgG, IgМ и IgА имеются подклассы. Легкие цепи во всех иммуноглобулинах подобные, но двух видов: c- или λ. ІgМ является пентамером, олигомером может быть также
ІgА. Наибольшая молекулярная масса у ІgМ - около 900 000. Все Ig содержат углеводный компонент - от 3 до 12% от общей массы. ІgА( а именно секреторный иммуноглобулин) содержит также дополнительный секреторный компонент, с помощью которого он переносится из крови в другие биологические жидкости (слюна, слеза, молоко и прочие) и в слизистые оболочки. Наибольшую способность к связыванию комплемента имеет комплекс антигена с ІgМ и IgG. В крови циркулируют в основном ІgG, IgА(сывороточный) и IgМ, очень мало IgD и IgE. Через плаценту проходит лишь IgG, который во время беременности осуществляет иммунологическую защиту плода.
Биологическое значение каждого иммуноглобулина разное. Наибольшее значение имеет IgG, уровень которого в крови самый высокий, у него же наиболее длинный период полужизни. Во фракции IgG содержится огромное количество антител разнообразной специфичности. В условиях иммунопатологии антитела класса IgG могут вызывать аллергию немедленного типа.
ІgМ имеет свойства опсонинов, то есть реагируя с бактериями ІgМ оказывает содействие их фагоцитозу. К классу ІgМ относятся так называемые «нормальные» (естественные) антитела. В противоположность «иммунным» антителам, они постоянно находятся в крови.
Секреторный ІgА осуществляет, пограничную, барьерную иммунологическую защиту, так как содержится в большом количестве в слизистых оболочках, их секретах и биологических жидкостях ( особенно в молоке). Поэтому ІgА имеет особое значение для детского возраста. Первое молоко матери - молозивное - представляет собой по сути концентрат ІgА. Содержание ІgА в молоке матери после родов постепенно снижается и достигает минимального уровня на 6 месяц лактации. Напомним, что именно в это время в основном завершается формирование собственной системы иммунитета ребенка.
Антитела класса IgD владеют противовирусной активностью. К классу IgD принадлежит часть аутоантител. ІgЕ принадлежат к так называемым «реагинам». Из крови они переходят в ткани, где адсорбируются на поверхности базофилов и других клеток, отвечают за проявление местной аллергии. Одно из направлений лечения аллергии - торможение синтеза ІgЕ.
Все антитела синтезируются плазматическими клетками, которые возникают вследствие дифференциации В-лимфоцитов. Антитела исключительно гетерогенные. Почему? Во-первых потому, что есть два варианта легких цепей и несколько подклассов тяжелых цепей. Во-вторых потому, что есть много клонов плазматических клеток, а клетки каждого клона вырабатывают уникальные по структуре антитела за счет изменений аминокислотной последовательности в вариабельных участках обеих цепей.
Считают, что количество вариантов антител достигает нескольких миллионов. Поскольку количество генов в геноме человека равняется приблизительно 30 тысячам, то возникновение генных локусов для синтеза каждого из миллионов антител можно объяснить лишь процессом рекомбинации генов.
Схема образования генного локуса (для легкой цепи иммуноглобулинов),
который отвечает за синтез легкой цепи иммуноглобулинов (в процессе дифференциации стволовой клетки в В-лимфоцит).
Семейство V ( 500 генов) семейство I (5-6 генов) семейство С (10-20 генов)
Новообразованный генный локус
Авторское право на материал
Копирование материалов допускается только с указанием активной ссылки на статью!
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Похожие статьи