Иммунохимия - наука, которая изучает явления иммунитета на молекулярном уровне. Иммунохимия как наука возникла в 30-х годах XX столетия в результате фундаментальных исследований К.Ландштейнера и С.Бойдена. Эти исследователи раскрыли химическую природу иммунологической специфичности. Большой вклад в развитие иммунологии и иммунохимии внесли ученые украинского происхождения - П.Грабар (Франция) и Ф.Бернет (Австралия).
Основное понятие - иммунитет. Термин происходит от латинского слова immunitas, что в переводе означает освобождение от чего-либо. Отсюда старое определение иммунитета как стойкости организма к инфекции (то есть - освобождение организма от возбудителей инфекции). Но с течением времени оказалось, что иммунологическую основу имеют не только процессы взаимодействия макро- и микроорганизма. Возникла так называемая неинфекционная иммунология, которая изучает аутоиммунные явления, лечебную аллергию, трансплантационный и противоопухолевый иммунитет и прочее. Поэтому появилась необходимость дать новое определение иммунитета как способа освобождения организма от чужеродной, несвойственной организму информации.
Основное понятие - иммунитет. Термин происходит от латинского слова immunitas, что в переводе означает освобождение от чего-либо. Отсюда старое определение иммунитета как стойкости организма к инфекции (то есть - освобождение организма от возбудителей инфекции). Но с течением времени оказалось, что иммунологическую основу имеют не только процессы взаимодействия макро- и микроорганизма. Возникла так называемая неинфекционная иммунология, которая изучает аутоиммунные явления, лечебную аллергию, трансплантационный и противоопухолевый иммунитет и прочее. Поэтому появилась необходимость дать новое определение иммунитета как способа освобождения организма от чужеродной, несвойственной организму информации.
Клиническая энзимология. Различают энзимопатологию, энзимодиагностику и энзимо терапию.
Энзимопатология это заболевания, которые обусловлены отсутствием или снижением ак тивности ферментов. В основном это – наследственные болезни, обусловленные генетиче скими нарушениями. Их называют молекулярными болезнями. Например:
• дефекты ферментов обмена фенилаланина возникают при снижении активности
фенилаланингидроксилазы (фенилпировиноградная олигофрения)
• дефект галактозо1фосфатуридилтрансферазы) галактоземия;
• дефекты ферментов обмена гликогена – гликогенозы;
• дефекты ферментов обмена липидов – липидозы, болезнь НиманаПика и др.
Энзимопатология это заболевания, которые обусловлены отсутствием или снижением ак тивности ферментов. В основном это – наследственные болезни, обусловленные генетиче скими нарушениями. Их называют молекулярными болезнями. Например:
• дефекты ферментов обмена фенилаланина возникают при снижении активности
фенилаланингидроксилазы (фенилпировиноградная олигофрения)
• дефект галактозо1фосфатуридилтрансферазы) галактоземия;
• дефекты ферментов обмена гликогена – гликогенозы;
• дефекты ферментов обмена липидов – липидозы, болезнь НиманаПика и др.
Существуют 2 пути регуляции скоро сти катализируемых ферментами реакций: 1. Через изменение каталитической активности фермента. 2. Через изменение количества молекул фермента;
Первый путь регуляции ферментативных реакций (через изменение активности фермен та) является очень быстрым и для изменения активности фермента требуются секунды или минуты. Чаще всего этот путь регуляции осуществляется благодаря наличию специальных регуляторных ферментов, которые находятся в начале или на перекрестках метаболиче ских путей. Имеются такие варианты регуляции активности ферментов:
1. По закону действующих масс: Из этого закона следует, что при повышении концентра ции субстрата автоматически повышается скорость ферментативной реакции.
2. Аллостерическая регуляция активности ферментов. Аллостерические ферменты име ют кроме активного центра, еще регуляторный (аллостерический) центр. С аллостериче скими центрами взаимодействуют аллостерические регуляторы (эффекторы, модуляторы), способные изменить активность фермента. При этом модуляторами аллостерических фер ментов могут как собственные субстраты (гомотропные регуляторные ферменты), так и продукты других метаболических путей (гетеротропные регуляторные ферменты).
Первый путь регуляции ферментативных реакций (через изменение активности фермен та) является очень быстрым и для изменения активности фермента требуются секунды или минуты. Чаще всего этот путь регуляции осуществляется благодаря наличию специальных регуляторных ферментов, которые находятся в начале или на перекрестках метаболиче ских путей. Имеются такие варианты регуляции активности ферментов:
1. По закону действующих масс: Из этого закона следует, что при повышении концентра ции субстрата автоматически повышается скорость ферментативной реакции.
2. Аллостерическая регуляция активности ферментов. Аллостерические ферменты име ют кроме активного центра, еще регуляторный (аллостерический) центр. С аллостериче скими центрами взаимодействуют аллостерические регуляторы (эффекторы, модуляторы), способные изменить активность фермента. При этом модуляторами аллостерических фер ментов могут как собственные субстраты (гомотропные регуляторные ферменты), так и продукты других метаболических путей (гетеротропные регуляторные ферменты).
Кинетика ферментативных реакций. Этот раздел энзимологии изучает влияние хими ческих и физических факторов на скорость ферментативной реакции. В 1913 г. Михаэлис и Ментен создали теорию ферментативной кинетики, исходя из того, что фермент (Е) вступает во взаимодействие с субстратом (S) с образованием промежуточного ферментсубстратного комплекса (ЕS), который далее распадается на фермент и продукт реакции по уравнению:
Каждый этап взаимодействия субстрата с ферментом характеризуется своими константами скорости. Отношение суммы констант скорости распада ферментсубстратного комплекса к константе скорости образования ферментсубстратного комплекса называется константой Михаелиса (Кm). Она определят сродство фермента к субстрату. Чем ниже константа Михаелиса, тем выше сродство фермента к субстрату, тем выше скорость ка тализируемой им реакции. По величине Кm каталитические реакции можно поделить на быстрые (Кm 106 моль/л и меньше) и медленные ( Кm 102 до 106).
Каждый этап взаимодействия субстрата с ферментом характеризуется своими константами скорости. Отношение суммы констант скорости распада ферментсубстратного комплекса к константе скорости образования ферментсубстратного комплекса называется константой Михаелиса (Кm). Она определят сродство фермента к субстрату. Чем ниже константа Михаелиса, тем выше сродство фермента к субстрату, тем выше скорость ка тализируемой им реакции. По величине Кm каталитические реакции можно поделить на быстрые (Кm 106 моль/л и меньше) и медленные ( Кm 102 до 106).
С точки зрения термодинамики ферменты ускоряют ход химической реакции за счет снижения энергии активации. Энергияактивации – это количество энергии, которое необ ходимо для перевода всех молекул 1 моля вещества в активное состояние.Энергетический барьер – это такое количество энергии, которое необходимо преодолеть молекулам, чтобы вступить в химическое взаимодей ствие. Величина энергии активации равня ется величине энергетического барьера. Благодаря взаимодействию субстрата с ферментом (образование фермент субстратного комплекса) химическая ре акция, имеющая высокий энергетический барьер, разбивается на две и больше ста дий, каждая из которых имеет более низ кий энергетический барьер и протекание которых требует меньших затрат энергии. Поэтому, считается, что фермент снижает энергетический барьер, катализируемой им реакции.
Типы каталитических процессов:
1) кислотный катализ – внедрение протона в субстрат;
2) щелочной катализ – отрыв протона от субстрата;
3) электрофильний катализ – внедрение электрона в субстрат;
4) нуклеофильний катализ – отрыв электрона от субстрата.
Эти процессы ведут к ослаблению связей, что облегчает прохождение химической реакции.
1) кислотный катализ – внедрение протона в субстрат;
2) щелочной катализ – отрыв протона от субстрата;
3) электрофильний катализ – внедрение электрона в субстрат;
4) нуклеофильний катализ – отрыв электрона от субстрата.
Эти процессы ведут к ослаблению связей, что облегчает прохождение химической реакции.
Механизм действия ферментов. Считается, что взаимодействие фермента и субстрата происходит по закону комплементарности. То есть конформация активного центра фермента должна соответствовать конфигурации субстрата (они подходят друг другу как ключ к зам ку). Позже была предложена теория «индуцированного» соответствия – замок формируется только в момент приближения субстрата к активному центру фермента. В процессе взаимо действия субстрата с ферментом выделяют 5 этапов:
1) присоединение фермента к субстрату и образование ферментсубстратного комплекса;
2) квантово–механические сдвиги, которые приводят к ослаблению связей;
3) разрыв или образование связей;
4) образование новых связей ведет к образованию продукта реакции, конфигурация которого уже не соответствует активному центру фермента;
5) освобождение продуктов реакции от фермента.
1) присоединение фермента к субстрату и образование ферментсубстратного комплекса;
2) квантово–механические сдвиги, которые приводят к ослаблению связей;
3) разрыв или образование связей;
4) образование новых связей ведет к образованию продукта реакции, конфигурация которого уже не соответствует активному центру фермента;
5) освобождение продуктов реакции от фермента.
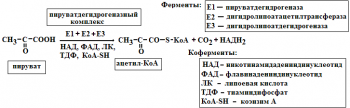
Мультиферментные комплексы это надмолекулярные образования которые включают, несколько ферментов и коферментов. Они катализируют последовательные этапы реакции преобразования одного субстрата. Примером мультиферментов являются реакции окисли тельного декарбоксилирования αкетокислот (пирувата и αкетоглутарата) под влиянием пи руватдегидрогеназы и αкетоглутаратдегидрогеназы. Например пируватдегидрогеназный комплекс включает 3 фермента и использует 5 коферментов
Биологическое значение мультиферментных комплексов состоит в том, что благодаря их существованию облегчается перенос реагирующих веществ между отдельными фермен тами и коферментами, что ускоряет протекание реакций. Мультиферментные комплексы, как правило, формируются на мембранах путем самосборки.
Биологическое значение мультиферментных комплексов состоит в том, что благодаря их существованию облегчается перенос реагирующих веществ между отдельными фермен тами и коферментами, что ускоряет протекание реакций. Мультиферментные комплексы, как правило, формируются на мембранах путем самосборки.
Изоферменты. Часть ферментов состоят не из одной белковой цепочки, а из нескольких субъединиц. Изоферменты – это семейство ферментов, которые катализируют одну и ту же реакцию, но отличаются по строению и физикохимическим свойствам. Например: лактатде гидрогеназа (ЛДГ) состоит их 4 субъединиц 2хтипов: субъединица Н, выделенная из сер дечной мышцы (heart – сердце), субъединица М, выделенная из скелетных мышц (musculus – мышца). Эти субъединицы кодируются разными генами. В разных органах имеются различ ные формы ЛДГ с различным набором субъединиц. Известно 5 изоферментов ЛДГ:
ЛДГ1: ЛДГ2: ЛДГ3: ЛДГ4: ЛДГ5: (Н4) (Н3М) (Н2М2) (НМ3) (М4)
ЛДГ1 экспрессируется в сердечной мышце и мозге, а ЛДГ5 – в скелетных мышцах и печени. Остальные формы в других органах. Появление ЛДГ в крови свидетельствует о повреждении органов (фермент из разрушенных клеток поступает в кровь – гиперферментемия) Повыше ние активности фракции ЛДГ1 в крови наблюдается при повреждении сердечной мышцы (инфаркт миокарда), а повышение активности ЛДГ5 в крови наблюдается при гепатитах и повреждении скелетных мышц. То есть благодаря изоферментам можно определить локали зацию поврежденного органа. Наиболее чувствительным тестом на инфаркт миокарда явля ется повышение в крови сердечного изофермента креатинкиназы.
ЛДГ1: ЛДГ2: ЛДГ3: ЛДГ4: ЛДГ5: (Н4) (Н3М) (Н2М2) (НМ3) (М4)
ЛДГ1 экспрессируется в сердечной мышце и мозге, а ЛДГ5 – в скелетных мышцах и печени. Остальные формы в других органах. Появление ЛДГ в крови свидетельствует о повреждении органов (фермент из разрушенных клеток поступает в кровь – гиперферментемия) Повыше ние активности фракции ЛДГ1 в крови наблюдается при повреждении сердечной мышцы (инфаркт миокарда), а повышение активности ЛДГ5 в крови наблюдается при гепатитах и повреждении скелетных мышц. То есть благодаря изоферментам можно определить локали зацию поврежденного органа. Наиболее чувствительным тестом на инфаркт миокарда явля ется повышение в крови сердечного изофермента креатинкиназы.
Химическая природа и структура ферментов. Большинство ферментов имеют белко вую природу, но ферментативной активностью обладает также иРНК (работы Томаса Чека).
Доказательства белковой природы ферментов таковы: а) потеря активности при кипя чении; б) денатурация при УФ и рентгеновском облучении, действии ультразвука, кислот, щелочей, тяжелых металлов; в) гидролиз до аминокислот; г) осаждение под действием солей (высаливание) без потери каталитических свойств; д) высокая молекулярная масса, амфотерные свойства, способность к электрофорезу; е) возможность искусственного синтеза из ами нокислот (впервые так была синтезирована рибонуклеаза).
Структураферментов. Ферменты делятся на простые и сложные. Простые ферменты явля ются белками и состоят только из аминокислот (например, ферменты 3 класса гидролазы). Сложные ферменты состоят из белкового компонента (апофермента) и небелкового (кофак тора). Кофактор может быть неорганической (металлы) и органической природы и в зависи мости от прочности связи с апоферментом делятся на простетические группы (прочно, ко валентно связаны с апоферментом) и коферменты (слабо, нековалентно связаны с апофер ментом). В целом сложный фермент (апофермент + кофактор) называется холоферментом.
Доказательства белковой природы ферментов таковы: а) потеря активности при кипя чении; б) денатурация при УФ и рентгеновском облучении, действии ультразвука, кислот, щелочей, тяжелых металлов; в) гидролиз до аминокислот; г) осаждение под действием солей (высаливание) без потери каталитических свойств; д) высокая молекулярная масса, амфотерные свойства, способность к электрофорезу; е) возможность искусственного синтеза из ами нокислот (впервые так была синтезирована рибонуклеаза).
Структураферментов. Ферменты делятся на простые и сложные. Простые ферменты явля ются белками и состоят только из аминокислот (например, ферменты 3 класса гидролазы). Сложные ферменты состоят из белкового компонента (апофермента) и небелкового (кофак тора). Кофактор может быть неорганической (металлы) и органической природы и в зависи мости от прочности связи с апоферментом делятся на простетические группы (прочно, ко валентно связаны с апоферментом) и коферменты (слабо, нековалентно связаны с апофер ментом). В целом сложный фермент (апофермент + кофактор) называется холоферментом.
1. Активаторы – вещества, которые повышают скорость ферментативных реакций, увеличивают активность ферментов. Они бывают органической и неорганической природы.
Активаторы органической природы: желчные кислоты (активируют поджелудочную ли пазу), энтерокиназа (активирует трипсиноген), глутатион, цистеин, витамин С (повышают активность оскидоредуктаз).
Активаторы неорганической природы: например, HCl активирует пепсиноген, ионы ме таллов (Na, Cl, K, Mg, Mn, Zn) активируют очень многие ферменты. Ионы металлов: а) спо собствуют образованию ферментсубстратного комплекса; б) служат донорами и акцептора ми электронов; в) принимают участие в образовании активного центра ферментов (Zn в со ставе карбангидразы, Fe – в составе цитохромов, каталазы, пероксидазы); г) выступают в ро ли аллостерических регуляторов.
Активаторы органической природы: желчные кислоты (активируют поджелудочную ли пазу), энтерокиназа (активирует трипсиноген), глутатион, цистеин, витамин С (повышают активность оскидоредуктаз).
Активаторы неорганической природы: например, HCl активирует пепсиноген, ионы ме таллов (Na, Cl, K, Mg, Mn, Zn) активируют очень многие ферменты. Ионы металлов: а) спо собствуют образованию ферментсубстратного комплекса; б) служат донорами и акцептора ми электронов; в) принимают участие в образовании активного центра ферментов (Zn в со ставе карбангидразы, Fe – в составе цитохромов, каталазы, пероксидазы); г) выступают в ро ли аллостерических регуляторов.
Центры ферментов: Молекула фермента взаимодействует с субстратом не всей своей по верхностью, а определенными участками. На поверхности фермента различают:
Активныйцентр – это участок фермента, который взаимодействует с субстратом. Ак тивных центров может быть 2, 4, 6, 8, в каждый входят 715 аминокислот. Наиболее часто в состав активных центров ферментов входят функциональные группы таких аминокислот:
ОН – группы серина, треонина, тирозина;
SН – группы цистеина;
NН – группа гистидина;
СООН – группы глутамата и аспартата;
NН2 – группы аргинина и лизина.
Активныйцентр – это участок фермента, который взаимодействует с субстратом. Ак тивных центров может быть 2, 4, 6, 8, в каждый входят 715 аминокислот. Наиболее часто в состав активных центров ферментов входят функциональные группы таких аминокислот:
ОН – группы серина, треонина, тирозина;
SН – группы цистеина;
NН – группа гистидина;
СООН – группы глутамата и аспартата;
NН2 – группы аргинина и лизина.