I. Выделение белка из смеси в чистом виде (по одному из признаков: размер молекулы, заряд, специфическое сродство связывания). Определение М.
II. Определение N-концевой АК. III. Определение С-концевой АК.
IV. Определение АК-последовательности белковой цепи.
Выделение белка из биологического материала основано на его физико-химических свойствах. Чаще всего для этих целей используют кислотно-основные свойства белков (амфотерность, заряд молекулы, изоэлектрическое состояние).
От заряда белковых молекул зависит их: растворимость (минимальна в ИЗС); электрофоретическая подвижность; структура и биологическая активность.
При растворении в водной среде на поверхности белковой молекулы формируется
гидратная оболочка.
Устойчивость белка в растворе зависит от:
1)заряда белковой молекуы;
2)наличия гидратной оболочки;
3)молекулярной массы белка.
II. Определение N-концевой АК. III. Определение С-концевой АК.
IV. Определение АК-последовательности белковой цепи.
Выделение белка из биологического материала основано на его физико-химических свойствах. Чаще всего для этих целей используют кислотно-основные свойства белков (амфотерность, заряд молекулы, изоэлектрическое состояние).
От заряда белковых молекул зависит их: растворимость (минимальна в ИЗС); электрофоретическая подвижность; структура и биологическая активность.
При растворении в водной среде на поверхности белковой молекулы формируется
гидратная оболочка.
Устойчивость белка в растворе зависит от:
1)заряда белковой молекуы;
2)наличия гидратной оболочки;
3)молекулярной массы белка.
Многие белки в своем составе, помимо аминокислот, могут содержать и небелковые компоненты. Эти соединения в составе белков называют простетической группой. Простетические группы с белком соединяются разными типами связей.
В зависимости от химического состава простетической группы сложные белки можно разделить на несколько классов.
1. Хромопротеины. Это белки, простетическая группа которых имеет окраску. К ним относятся многие белки, содержащие металлы. Например, церулоплазмин — белок, содержащий медь, имеет синюю окраску. Белки, содержащие железо: гемоглобин, миоглобин, цитохромы. Они имеют красную окраску. Присутствие витамина B2 придает белкам желтый цвет (флавопротеины).
Простетическая группа хромопротеинов связана с гистидином полипептидной цепи координационными связями.
2. Гликопротеины. Это белки, простетическая группа которых содержит углеводы. Углевод соединяется с белковой частью ковалентными связями. В соединении с углеводом участвует OH-группа аминокислоты серина или треонина. Гликопротеины — это часть белково-углеводных комплексов. Этим белкам принадлежит важная роль в структурной организации клеток и тканей, они выполняют защитные функции. Основная часть внеклеточных белков — это гликопротеины.
В зависимости от химического состава простетической группы сложные белки можно разделить на несколько классов.
1. Хромопротеины. Это белки, простетическая группа которых имеет окраску. К ним относятся многие белки, содержащие металлы. Например, церулоплазмин — белок, содержащий медь, имеет синюю окраску. Белки, содержащие железо: гемоглобин, миоглобин, цитохромы. Они имеют красную окраску. Присутствие витамина B2 придает белкам желтый цвет (флавопротеины).
Простетическая группа хромопротеинов связана с гистидином полипептидной цепи координационными связями.
2. Гликопротеины. Это белки, простетическая группа которых содержит углеводы. Углевод соединяется с белковой частью ковалентными связями. В соединении с углеводом участвует OH-группа аминокислоты серина или треонина. Гликопротеины — это часть белково-углеводных комплексов. Этим белкам принадлежит важная роль в структурной организации клеток и тканей, они выполняют защитные функции. Основная часть внеклеточных белков — это гликопротеины.
Кислотно-основные свойства
1.Амфотерность
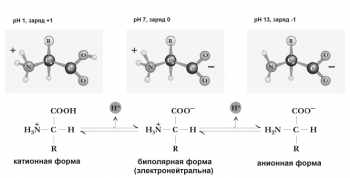
Аминокислоты имеют 2 функциональные группы с противоположными свойствами: кислую карбоксильную и основную аминогруппу. Поэтому в водном растворе аминокислоты существуют в виде биполярного иона.
При добавлении в раствор аминокислот дополнительного количества протонов (кислоты) подавляется диссоциация карбоксильных групп и увеличивается количество NH3+-групп. Аминокислоты при этом переходят в катионную форму (приобретают положительный заряд). При добавлении щелочи, наоборот, увеличивается диссоциация карбоксильных групп. Аминокислоты переходят в анионную форму (приобретают отрицательный заряд). Изменяя, таким образом, pH раствора, можно изменять заряд молекул аминокислот.
1.Амфотерность
Аминокислоты имеют 2 функциональные группы с противоположными свойствами: кислую карбоксильную и основную аминогруппу. Поэтому в водном растворе аминокислоты существуют в виде биполярного иона.
При добавлении в раствор аминокислот дополнительного количества протонов (кислоты) подавляется диссоциация карбоксильных групп и увеличивается количество NH3+-групп. Аминокислоты при этом переходят в катионную форму (приобретают положительный заряд). При добавлении щелочи, наоборот, увеличивается диссоциация карбоксильных групп. Аминокислоты переходят в анионную форму (приобретают отрицательный заряд). Изменяя, таким образом, pH раствора, можно изменять заряд молекул аминокислот.
I. По строению радикала
1.Алифатические (гли, ала, вал, лей, илей).
2.Гидроксиаминокислоты (сер, тре).
3.Дикарбоновые (асп, глу).
4.Амиды дикарбоновых кислот (асн, глн).
5.Серосодержащие (мет, цис).
1.Алифатические (гли, ала, вал, лей, илей).
2.Гидроксиаминокислоты (сер, тре).
3.Дикарбоновые (асп, глу).
4.Амиды дикарбоновых кислот (асн, глн).
5.Серосодержащие (мет, цис).
1.Регуляторная (пептиды ренин-ангиотензивной системы и др.).
2.Гормоны (окситоцин, инсулин, глюкагон).
3.Антибиотики (пенициллин, цефалоспорины).
4.Токсины (аманитотоксин).
5.Антиоксиданты (глутатион).
6.Нейропептиды (энкефалины, эндорфины — обезболивающий эффект). Главные составные части белка — аминокислоты.
2.Гормоны (окситоцин, инсулин, глюкагон).
3.Антибиотики (пенициллин, цефалоспорины).
4.Токсины (аманитотоксин).
5.Антиоксиданты (глутатион).
6.Нейропептиды (энкефалины, эндорфины — обезболивающий эффект). Главные составные части белка — аминокислоты.
I. Функциональная (по функции, выполняемой в организме)
1.Каталитическая (более 3000 белков — ферменты).
2.Сократительная (актин, миозин и т. д.).
3.Структурная (белки плазматических мембран, коллаген, эластин и др.).
4.Транспортная (транспорт веществ в крови и клетке: гемоглобин, цитохром с, липопротеины и др.).
5.Защитная (антитела, иммуноглобулины).
1.Каталитическая (более 3000 белков — ферменты).
2.Сократительная (актин, миозин и т. д.).
3.Структурная (белки плазматических мембран, коллаген, эластин и др.).
4.Транспортная (транспорт веществ в крови и клетке: гемоглобин, цитохром с, липопротеины и др.).
5.Защитная (антитела, иммуноглобулины).
Мембраны – это надмолекулярные структуры, отделяют клетку от окружающей среды и делят ее на компартменты. Различают внешнюю (плазматическую) и внутриклеточные мембраны органелл (ядра, митохондрий, лизосом и т.д.).
Состоят мембраны из белков и липидов. Белков до 60 – 85% от массы, а в миелиновых мембранах (окружают нервы) больше липидов. Основу липидного слоя составляют фосфолипиды: фосфатидилхолин, фосфатидилэтаноламин, холестерин.
Фосфолипиды амфипатические соединения: гидрофильная головка (Рн. + глицерол), гидрофобный хвост – радикалы жирных кислот. В состав фосфолипидов входят ненасыщенные жирные кислоты. Образуется двуслойная мембрана, липидный бислой, в который встроены белки: поверхностные (располагаются на поверхности мембраны) и интегральные (пронизывают мембрану насквозь). Липидный слой находится в текучем состоянии. Молекулы фосфолипидов и белков двигаются вдоль поверхности мембраны. Поэтому говорят о латеральной диффузии компонентов мембран. Холестерин уплотняет липидный бислой мембран, делает его более прочным и уменьшает текучесть мембранных липидов. Ассиметрия мембраны – на внешней поверхности белков больше чем на внутренней.
Состоят мембраны из белков и липидов. Белков до 60 – 85% от массы, а в миелиновых мембранах (окружают нервы) больше липидов. Основу липидного слоя составляют фосфолипиды: фосфатидилхолин, фосфатидилэтаноламин, холестерин.
Фосфолипиды амфипатические соединения: гидрофильная головка (Рн. + глицерол), гидрофобный хвост – радикалы жирных кислот. В состав фосфолипидов входят ненасыщенные жирные кислоты. Образуется двуслойная мембрана, липидный бислой, в который встроены белки: поверхностные (располагаются на поверхности мембраны) и интегральные (пронизывают мембрану насквозь). Липидный слой находится в текучем состоянии. Молекулы фосфолипидов и белков двигаются вдоль поверхности мембраны. Поэтому говорят о латеральной диффузии компонентов мембран. Холестерин уплотняет липидный бислой мембран, делает его более прочным и уменьшает текучесть мембранных липидов. Ассиметрия мембраны – на внешней поверхности белков больше чем на внутренней.
Аминокислоты – это производные карбоновых кислот, в которых атом водорода в αположении замещён на амино (-NH2) группу. Аминокислоты, входящие в состав белков и пептидов (протеиногенные) имеют общее строение: 1) аминогруппа находится в α-положении относительно карбоксильной группы; 2) все протеиногенные аминокислоты являются стереоизомерами L-ряда
Классификация протеиногенных аминокислот
I. В зависимости от химического строения бокового радикала различают:
1. Ациклические аминокислоты, которые в свою очередь в зависимости от количества аминои карбоксильных групп делятся на: а) моноаминомонокарбоновые (например, глицин, валин и др.); б) моноаминодикарбоновые (аспарагиновая, глутаминовая кислоты); диаминомонокарбоновые (лизин, аргинин).
Классификация протеиногенных аминокислот
I. В зависимости от химического строения бокового радикала различают:
1. Ациклические аминокислоты, которые в свою очередь в зависимости от количества аминои карбоксильных групп делятся на: а) моноаминомонокарбоновые (например, глицин, валин и др.); б) моноаминодикарбоновые (аспарагиновая, глутаминовая кислоты); диаминомонокарбоновые (лизин, аргинин).
Белки – протеины (protos первый, значимый) Белки и пептиды – это биополимеры, состоящие из аминокислот. Белки имеют молекулярную массу больше 6-10 тысяч дальтон, а пептиды меньше этих величин.
Элементный состав белков: С – 50-55%; Н – 6-7%; О – 21-23%; N – 15-18% (≈16%); S – 0-1,5% Количество белка можно рассчитать по количеству азота, т.к. его содержание в белках является практически постоянной величиной – 16 г азота в 100 г белка. Поэтому коэффициент пересчета по азоту равняется 6,25 (100 : 16 = 6,25).
Количество белка изменяется с возрастом, также несколько меняются и физикохимические свойства некоторых белков. В разных органах количество белка в пересчете на сухую массу различно, в мозге – 45%, легких – 82%, селезенке – 84%, сердце – 20%.
Элементный состав белков: С – 50-55%; Н – 6-7%; О – 21-23%; N – 15-18% (≈16%); S – 0-1,5% Количество белка можно рассчитать по количеству азота, т.к. его содержание в белках является практически постоянной величиной – 16 г азота в 100 г белка. Поэтому коэффициент пересчета по азоту равняется 6,25 (100 : 16 = 6,25).
Количество белка изменяется с возрастом, также несколько меняются и физикохимические свойства некоторых белков. В разных органах количество белка в пересчете на сухую массу различно, в мозге – 45%, легких – 82%, селезенке – 84%, сердце – 20%.
Принципы функционирования живой материи
1. Все реакции в живых организмах подчиняются ІІ закону термодинамики и происходят по закону действующих масс
2. Большинство реакций в живых организмах являются ферментативными, то есть протекают при участии ферментов – катализаторов белковой природы
3. Все реакции в живых организмах протекают в водной среде, в том числе и реакции окисления, при относительно невысоких температурах.
4. Энергия в организмах выделяется при окислении питательных веществ (углеводов, белков, жиров) и значительная ее часть аккумулируется в виде макроэргических связей АТФ.
1. Все реакции в живых организмах подчиняются ІІ закону термодинамики и происходят по закону действующих масс
2. Большинство реакций в живых организмах являются ферментативными, то есть протекают при участии ферментов – катализаторов белковой природы
3. Все реакции в живых организмах протекают в водной среде, в том числе и реакции окисления, при относительно невысоких температурах.
4. Энергия в организмах выделяется при окислении питательных веществ (углеводов, белков, жиров) и значительная ее часть аккумулируется в виде макроэргических связей АТФ.
Принципы организации живой материи:
1. Принцип молекулярной экономии – комбинация небольшого числа молекул дает бесконечное множество макромолекул. Например, миллионы белков составлены из набора в 20 аминокислот, а в состав ДНК входят в основном 4 азотистых основания.
2. Принцип простой сложности – все биомолекулы состоят из нескольких элементов – органогенов (С, Н, О, N, S, P).
3. Принцип комплементарности – необходимость пространственного соответствия отдельных частей биомолекул при их образовании (например, для ДНК – это расположение азотистых оснований по правилам Чаргаффа), а также при взаимодействии макромолекул (например, комплексы антиген-антитело, фермент-субстрат и т.д.) по типу «ключ-замок».
1. Принцип молекулярной экономии – комбинация небольшого числа молекул дает бесконечное множество макромолекул. Например, миллионы белков составлены из набора в 20 аминокислот, а в состав ДНК входят в основном 4 азотистых основания.
2. Принцип простой сложности – все биомолекулы состоят из нескольких элементов – органогенов (С, Н, О, N, S, P).
3. Принцип комплементарности – необходимость пространственного соответствия отдельных частей биомолекул при их образовании (например, для ДНК – это расположение азотистых оснований по правилам Чаргаффа), а также при взаимодействии макромолекул (например, комплексы антиген-антитело, фермент-субстрат и т.д.) по типу «ключ-замок».
Биомолекулы – органические соединения, входящие в состав организмов, образующие клеточные структуры и участвующие в биохимических реакциях обмена веществ.
Функции биомолекул в живых организмах.
а) участие в реакциях обмена веществ в роли промежуточных продуктов (метаболитов). Например, аминокислоты, моносахариды, жирные кислоты и др.
б) участие в образовании сложных молекул (белков, нуклеиновых кислот, липидов, полисахаридов) или биологических структур (мембран, рибосом, ядерного хроматина и др.).
в) участие в регуляции биохимических процессов и функций отдельных клеток и организма в целом (витамины, гормоны, циклические нуклеотиды цАМФ, цГМФ и др.).
Функции биомолекул в живых организмах.
а) участие в реакциях обмена веществ в роли промежуточных продуктов (метаболитов). Например, аминокислоты, моносахариды, жирные кислоты и др.
б) участие в образовании сложных молекул (белков, нуклеиновых кислот, липидов, полисахаридов) или биологических структур (мембран, рибосом, ядерного хроматина и др.).
в) участие в регуляции биохимических процессов и функций отдельных клеток и организма в целом (витамины, гормоны, циклические нуклеотиды цАМФ, цГМФ и др.).