Центры ферментов: Молекула фермента взаимодействует с субстратом не всей своей по верхностью, а определенными участками. На поверхности фермента различают:
Активныйцентр – это участок фермента, который взаимодействует с субстратом. Ак тивных центров может быть 2, 4, 6, 8, в каждый входят 715 аминокислот. Наиболее часто в состав активных центров ферментов входят функциональные группы таких аминокислот:
ОН – группы серина, треонина, тирозина;
SН – группы цистеина;
NН – группа гистидина;
СООН – группы глутамата и аспартата;
NН2 – группы аргинина и лизина.
Активныйцентр – это участок фермента, который взаимодействует с субстратом. Ак тивных центров может быть 2, 4, 6, 8, в каждый входят 715 аминокислот. Наиболее часто в состав активных центров ферментов входят функциональные группы таких аминокислот:
ОН – группы серина, треонина, тирозина;
SН – группы цистеина;
NН – группа гистидина;
СООН – группы глутамата и аспартата;
NН2 – группы аргинина и лизина.
Свойства ферментов как биокатализаторов:
1) Специфичность (избирательность) действия. Выделяют такие виды ее:
а) абсолютная специфичность – фермент катализирует превращение только одного субстрата (один фермент – один субстрат). Пример – уреаза, аргиназа, сахараза, лактаза и др.
б) стереоструктурная – фермент катализирует превращение определенного стереоизомера (лактатдегидрогеназа превращает только Lлактат)
в) относительная – фермент катализирует превращение группы веществ с одним типом хи мической связи (один фермент – одна связь). Пример пептидазы, эстеразы, гликозидазы.
2) Зависимость скорости ферментативной реакции от температуры. Ферментативные реак ции, как и все химические реакции, ускоряются при повышении температуры (в 24 раза на каждые 10оС). Однако скорость ферментативной реакции имеет свой температурныйопти мум, превышение которого приводит к понижению активности ферментов изза тепловой денатурации их молекул. Для большинства ферментативных реакций температурный опти мум 3840оС, а при 5060оС и выше скорость ферментативных реакций сильно уменьшается изза разрушения молекул фермента (искл. миокиназа не инактивируется даже при 100 оС). Зависимость активности ферментов от температуры называется термолабильностью. Фер менты лучше сохраняются при низких температурах – их активность снижается, но денату рации не происходит. Это свойство используется в медицине для производства препаратов ферментов. При некоторых операциях необходимо снизить скорость обмена веществ. Тогда используют охлаждение органов (например, при пересадке почек, сердца и др. органов).
1) Специфичность (избирательность) действия. Выделяют такие виды ее:
а) абсолютная специфичность – фермент катализирует превращение только одного субстрата (один фермент – один субстрат). Пример – уреаза, аргиназа, сахараза, лактаза и др.
б) стереоструктурная – фермент катализирует превращение определенного стереоизомера (лактатдегидрогеназа превращает только Lлактат)
в) относительная – фермент катализирует превращение группы веществ с одним типом хи мической связи (один фермент – одна связь). Пример пептидазы, эстеразы, гликозидазы.
2) Зависимость скорости ферментативной реакции от температуры. Ферментативные реак ции, как и все химические реакции, ускоряются при повышении температуры (в 24 раза на каждые 10оС). Однако скорость ферментативной реакции имеет свой температурныйопти мум, превышение которого приводит к понижению активности ферментов изза тепловой денатурации их молекул. Для большинства ферментативных реакций температурный опти мум 3840оС, а при 5060оС и выше скорость ферментативных реакций сильно уменьшается изза разрушения молекул фермента (искл. миокиназа не инактивируется даже при 100 оС). Зависимость активности ферментов от температуры называется термолабильностью. Фер менты лучше сохраняются при низких температурах – их активность снижается, но денату рации не происходит. Это свойство используется в медицине для производства препаратов ферментов. При некоторых операциях необходимо снизить скорость обмена веществ. Тогда используют охлаждение органов (например, при пересадке почек, сердца и др. органов).
Принципы определения активности ферментов:
по скорости исчезновения субстрата;
по скорости накопления продуктов реакции.
Единицы активности ферментов.1) За единицу активности фермента (Uunit, англ.) принимают такое количество фермента, которое катализирует превращение 1 мкмоля S (суб страта) за 1 мин. при оптимальных условиях (1U= 1 мкмоль/мин.)
2) В системе СИ активность выражают в каталах: 1 катал – количество фермента, катали зирующее превращение 1 моля S за 1 сек. при оптимальных условиях (1кат.=1 моль/с)
3)Удельнаяактивность определяется количеством единиц ферментативной активности, которое приходится на 1 мг белка в биологическом объекте (U/мг белка)
В медицинской энзимологии активность фермента выражают в единицах (U) на 1 л био логической жидкости (сыворотки крови, мочи.): U/л
по скорости исчезновения субстрата;
по скорости накопления продуктов реакции.
Единицы активности ферментов.1) За единицу активности фермента (Uunit, англ.) принимают такое количество фермента, которое катализирует превращение 1 мкмоля S (суб страта) за 1 мин. при оптимальных условиях (1U= 1 мкмоль/мин.)
2) В системе СИ активность выражают в каталах: 1 катал – количество фермента, катали зирующее превращение 1 моля S за 1 сек. при оптимальных условиях (1кат.=1 моль/с)
3)Удельнаяактивность определяется количеством единиц ферментативной активности, которое приходится на 1 мг белка в биологическом объекте (U/мг белка)
В медицинской энзимологии активность фермента выражают в единицах (U) на 1 л био логической жидкости (сыворотки крови, мочи.): U/л
Ферменты располагаются в субклеточных структурах (органеллах) соответственно их функциям. Например: а) в ядре содержатся ферменты преобразования нуклеиновых кислот; б) во внутренней мембране митохондрий – ферменты дыхательной цепи; в) в лизосомах – гидролазы; г) в цитоплазме – ферменты гликолиза, синтеза жирных кислот; д) в матриксе митохондрий – ферменты ЦТК, окислительного декарбоксилирования αкетокислот, β– окисления жирных кислот; е) плазматическая мембрана содержит ферменты транслоказы, которые переносят через мембрану ионы Nа+, К+, глюкозу, аминокислоты и т.д.
Классификация ферментов (построена по типу химических реакций):
1.класс – оксидоредуктазы: катализируют окислительновосстановительные процессы (дегидрогеназы, оксидазы, цитохромы).
2.класс – трансферазы: катализируют реакции переноса химических групп, название берут от группы, которую переносят (метилтрансферазы, сульфотрансферазы, аминотрансферазы, фосфотрансферазы, ацилтрансферазы).
3.класс – гидролазы: катализируют реакции гидролиза, т.е. расщепление субстрата с участи ем воды (пептидазы, эстеразы, фосфатазы, гликозидазы).
4.класс – лиазы: катализируют реакции расщепления ковалентных связей между атомами C, O, N, S негидролитическим путем (декарбоксилазы, альдолазы, дегидратазы).
5.класс – изомеразы: катализируют реакции изомеризации (эпимеразы, рацемазы, изомеразы).
6.класс–лигазы: (синтетазы) катализируют реакции синтеза молекул за счет энергии АТФ (АТФсинтаза, пируваткарбоксилаза).
1.класс – оксидоредуктазы: катализируют окислительновосстановительные процессы (дегидрогеназы, оксидазы, цитохромы).
2.класс – трансферазы: катализируют реакции переноса химических групп, название берут от группы, которую переносят (метилтрансферазы, сульфотрансферазы, аминотрансферазы, фосфотрансферазы, ацилтрансферазы).
3.класс – гидролазы: катализируют реакции гидролиза, т.е. расщепление субстрата с участи ем воды (пептидазы, эстеразы, фосфатазы, гликозидазы).
4.класс – лиазы: катализируют реакции расщепления ковалентных связей между атомами C, O, N, S негидролитическим путем (декарбоксилазы, альдолазы, дегидратазы).
5.класс – изомеразы: катализируют реакции изомеризации (эпимеразы, рацемазы, изомеразы).
6.класс–лигазы: (синтетазы) катализируют реакции синтеза молекул за счет энергии АТФ (АТФсинтаза, пируваткарбоксилаза).
Номенклатура ферментов принята V Международным конгрессом биохимиков (1961).
1. Систематическая номенклатура. Название фермента включает: химическое название субстрата; тип химической реакции (в соответствии с международной классификацией ферментов); суффикс «аза». Например: LЛактат:НАД+ оксидоредуктаза.
2. Рабочая номенклатура. Название фермента образуется из химического названия субстра та с добавлением суффикса «аза» либо из названия химического превращения субстрата с добавлением суффикса «аза». Например: lipos (жир), фермент катализирующий его превращение называется «липаза». Лактатдегидрогеназа это рабочее название фермен та LЛактат:НАД+ оксидоредуктазы.
3. Тривиальное (исторически сложившиеся) название. Не дает представления о субстрате или типе химического превращения. Пример пепсин, тромбин, трипсин, ренин. Согласно систематической номенклатуре каждому ферменту был дан код (шифр), со стоящий из 4х цифр, которые обозначают: 1класс, 2подкласс, 3подподкласс, 4порядковый номер фермента в подподклассе. Например: 1.1.1.27 лактатдегидрогеназа, которая относит ся к I классу – оксидоредуктазам.
1. Систематическая номенклатура. Название фермента включает: химическое название субстрата; тип химической реакции (в соответствии с международной классификацией ферментов); суффикс «аза». Например: LЛактат:НАД+ оксидоредуктаза.
2. Рабочая номенклатура. Название фермента образуется из химического названия субстра та с добавлением суффикса «аза» либо из названия химического превращения субстрата с добавлением суффикса «аза». Например: lipos (жир), фермент катализирующий его превращение называется «липаза». Лактатдегидрогеназа это рабочее название фермен та LЛактат:НАД+ оксидоредуктазы.
3. Тривиальное (исторически сложившиеся) название. Не дает представления о субстрате или типе химического превращения. Пример пепсин, тромбин, трипсин, ренин. Согласно систематической номенклатуре каждому ферменту был дан код (шифр), со стоящий из 4х цифр, которые обозначают: 1класс, 2подкласс, 3подподкласс, 4порядковый номер фермента в подподклассе. Например: 1.1.1.27 лактатдегидрогеназа, которая относит ся к I классу – оксидоредуктазам.
История энзимологии: В 1814 году Кирхгоф открыл, что солод ячменя вызывает броже ние крахмала. Дальнейшее развитие ферментологии связано с именами Либиха, Пастера, Манасеиной, Лебедева. В 1913 году Ментен и Михаэлис выдвинули теорию механизма дей ствия ферментов. В 1926 году (год рождения ферментологии как науки) Самнер выделил кристаллическую уреазу и доказал ее белковую природу. В 1969 году Меррифильд (Нью Йорк) синтезировал искусственно рибонуклеазу.
Общие понятия энзимологии. Ферменты (энзимы) – это биокатализаторы преимущест венно белковой природы (иРНК тоже имеют ферментативную активность), которые при нимают участие в химических реакциях в организме.
Слово «фермент» происходит от слова «fermentatio» брожение, а энзим – от «enzyme», что означает закваска в дрожжах. Наука, изучающая ферменты, называется энзимологией или ферментологией.
Принятые обозначения в энзимологии: Е – фермент, энзим (“еnzуме”).
S – субстрат – вещество, на которое действует фермент.
Р – продукт реакции – вещество, образовавшееся в результате ферментативной реакции
Значениеферментов: ферменты принимают участие в большинстве процессов проис ходящих в организме – 1) реакциях синтеза и распада веществ, 2) процессах переваривания и всасывания, 3) освобождения энергии, 4) обеспечивают координацию биохимических реак ций. Нарушение синтеза или активности ферментов приводит к возникновению болезней.
Слово «фермент» происходит от слова «fermentatio» брожение, а энзим – от «enzyme», что означает закваска в дрожжах. Наука, изучающая ферменты, называется энзимологией или ферментологией.
Принятые обозначения в энзимологии: Е – фермент, энзим (“еnzуме”).
S – субстрат – вещество, на которое действует фермент.
Р – продукт реакции – вещество, образовавшееся в результате ферментативной реакции
Значениеферментов: ферменты принимают участие в большинстве процессов проис ходящих в организме – 1) реакциях синтеза и распада веществ, 2) процессах переваривания и всасывания, 3) освобождения энергии, 4) обеспечивают координацию биохимических реак ций. Нарушение синтеза или активности ферментов приводит к возникновению болезней.
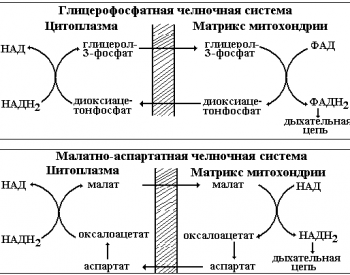
Образование Н2O2 и СО2.
Напомним, что тканевое дыхание это процесс поглощения кислорода (О2) тканями при окислении органического субстрата с выделением углекислого газа и воды. Выше мы уже показали, как из атомов водорода в дыхательной цепи образуются молекулы воды. Однако процесс дегидрирования субстрата НАД и ФАДзависимыми дегидрогеназами одновременно ведет и к отщеплению концевой карбоксильной группы, которая выделяется в виде СО2. Главными источниками СО2 является реакции декарбоксилирования пировиноградной и альфакетоглутаровой кислот (см. выше). Еще один источник – это процесс декарбоксилиро вание аминокислот, который катализируется пиридоксальзависимыми ферментами.
Поглощенный клеткой кислород в основном (до 8090%) используется для производства энергии в митохондриях. Однако, кислород используется и на другие цели – для синтеза сте роидов, простагландинов, лейкотриенов, тирозина, катехоламинов, для метаболизма чуже родных веществ и т.д.. При этом часть поглощенного тканями кислорода неферментативным путем или при участии монооксигеназ способна превращаться в активные формы (суперок сидный, гидроксильный. пероксильный радикалы, синглетный кислород, пероксид водорода, органическое пероксиды)
Напомним, что тканевое дыхание это процесс поглощения кислорода (О2) тканями при окислении органического субстрата с выделением углекислого газа и воды. Выше мы уже показали, как из атомов водорода в дыхательной цепи образуются молекулы воды. Однако процесс дегидрирования субстрата НАД и ФАДзависимыми дегидрогеназами одновременно ведет и к отщеплению концевой карбоксильной группы, которая выделяется в виде СО2. Главными источниками СО2 является реакции декарбоксилирования пировиноградной и альфакетоглутаровой кислот (см. выше). Еще один источник – это процесс декарбоксилиро вание аминокислот, который катализируется пиридоксальзависимыми ферментами.
Поглощенный клеткой кислород в основном (до 8090%) используется для производства энергии в митохондриях. Однако, кислород используется и на другие цели – для синтеза сте роидов, простагландинов, лейкотриенов, тирозина, катехоламинов, для метаболизма чуже родных веществ и т.д.. При этом часть поглощенного тканями кислорода неферментативным путем или при участии монооксигеназ способна превращаться в активные формы (суперок сидный, гидроксильный. пероксильный радикалы, синглетный кислород, пероксид водорода, органическое пероксиды)
Патология тканевого дыхания. Различают ингибиторы электронного транспорта, ингибиторы и разобщители окислительного фосфорилирования в митохондриях.
а) ингибиторы электронного транспорта – это вещества, которые взаимодействуют с компонентами дыхательной цепи и нарушают транспорт электронов по ней. Они являются клеточными токсинами, вызывают тканевую гипоксию. К ним относятся: 1) Ротенон (инсек тицид), снотворные препараты амобарбитал (амитал) и секобарбитал – тормозит транспорт электронов через НАДНКоQредуктазу; 2) Пиерицидин А (антибиотик), блокирует НАД Н КоQредуктазу; 3) Антимицин А (антибиотик), блокирует дыхательную цепь на уровне III комплекса (цитохром b–цитохром с); 4) Цианиды (ионы СN) – образуют комплексы с Fe3+ цитохромоксидазы, тормозят восстановление до Fe2+ в ЦХО; 5) Монооксид углерода (СО) – блокирует ЦХО, связываясь с гемом тормозит его взаимодействие с кислородом.
Тканевое дыхание угнетается также в том случае, если в организм с пищей поступает недостаточное количество витаминов РР и В2 (эти витамины являются предшественниками НАД и ФМН), а также микроэлементов железа и меди (Fe и Cu входят в состав цитохромов).
а) ингибиторы электронного транспорта – это вещества, которые взаимодействуют с компонентами дыхательной цепи и нарушают транспорт электронов по ней. Они являются клеточными токсинами, вызывают тканевую гипоксию. К ним относятся: 1) Ротенон (инсек тицид), снотворные препараты амобарбитал (амитал) и секобарбитал – тормозит транспорт электронов через НАДНКоQредуктазу; 2) Пиерицидин А (антибиотик), блокирует НАД Н КоQредуктазу; 3) Антимицин А (антибиотик), блокирует дыхательную цепь на уровне III комплекса (цитохром b–цитохром с); 4) Цианиды (ионы СN) – образуют комплексы с Fe3+ цитохромоксидазы, тормозят восстановление до Fe2+ в ЦХО; 5) Монооксид углерода (СО) – блокирует ЦХО, связываясь с гемом тормозит его взаимодействие с кислородом.
Тканевое дыхание угнетается также в том случае, если в организм с пищей поступает недостаточное количество витаминов РР и В2 (эти витамины являются предшественниками НАД и ФМН), а также микроэлементов железа и меди (Fe и Cu входят в состав цитохромов).
Окислительное фосфорилирование – это процесс образования АТФ из АДФ и неоргани ческого фосфата (Фн) в процессе тканевого дыхания. Согласно хемиосмотической теории Митчела синтез АТФ осуществляется за счет електрохимического потенциала, который созда ется градиентом концентраций ионов водорода. Комплексы I, III и IV расположены асимметрич но во внутренней мембране митохондрий и обра зуют 3 петли, которые обеспечивают перекачи вания протонов из матрикса митохондрий в межмембранное пространство. То есть комплек сы I, III и IV по сути служат протонными насоса ми. С каждой парой электронов, которые пере даются от субстрата к кислороду, эти три петли транспортируют в межмебранное простран ство 810 протонов (Н+). Источником протонов является диссоциация эндогенной воды: Н2O→Н++ОН, а энергия необходимая для транспорта ионов Н+ черпается за счет движения электронов. В матриксе накапливаются гидроксиданионы ОН, а в межмембранном про странстве ионы Н+ т.е. формируется трансмембранный электрохимический градиент кон центрации ионов Н+ – ∆µН+. Внешняя поверхность внутренней мембраны, обращенная в межмембранное пространство, заряжается положительно (+), а внутренняя отрицательно (). Внутренняя мембрана митохондрий непроницаема для ионов Н+, однако, они могут прохо дить назад в матрикс через протонный канал (фрагмент Fо) Н+АТФсинтазы. Второй фрагмент F1 фермента является каталитическим и осуществляет синтез АТФ. Каталитиче ская часть АТФсинтазы катализирует три последовательные стадии синтеза АТФ. Вначале идет связывание АДФ и неорганического фосфата (1 стадия), затем образуется фосфоангид ридная связь (2 стадия) и, наконец, освобождается конечный продукт реакции (3 стадия).
Редокспотенциал (РОП) – это величина электрического заряда, которая создается между платиновыми электродами, помещенными в раствор, содержащий окисленную и вос становленную форму вещества. Редокспотенциалы различных веществ приравнивают к во дородному потенциалу, величина которого принята за 0. Величины редокспотенциалов компонентов дыхательной цепи показы вают порядок движения электронов, на чиная с окисляемого субстрата (SН2), имеющего редокспотенциал 0,7V и заканчивая кислородом с редокс потенциалом +0,8V. Таким образом, электроны движутся по направлению от субстрата к кислороду, т.е. от соедине ний с меньшим редокспотенциалом к большему. При пересчете РОП в энер гию (уравнение ∆G= nF.∆E0) общий пе репад энергии в дыхательной цепи ра вен 220 кДж В дыхательной цепи имеются пункты где перепады РОП особенно велики. Так, на участке НАДН2 –коэнзим Q (комплекс I) изменение РОП составляет 0,27V, на участке ци тохром b – цитохром с (комплекс III) – 0,22V, и на участке цитохром а3 – О2 (комплекс IV) – 0,53V, что соответствует энергии, соответственно, 51,0, 41,4 и 99,6 кДж. Этой энергии доста точно для синтеза 3х молекул АТФ (синтез 1 молекулы АТФ требует затрат 30,5 кДж