Наука » Психология » Соционика
Итак, обо всем по порядку. Первые попытки типизации людей были предприняты еще на древнем Востоке китайскими астрологами. Они пытались объяснить различия людей при помощи 4-х так называемых стихий: огоня, воды, воздуха и земли.
Однако первые сколь нибудь заметные успехи в области исследования психики человека были достигнуты лишь в начале 20-го века и связаны они с именем известного психолога Зигмунда Фрейда. Он предложил рассматривать психику человека как некую структуру, в которой он выделял несколько уровней: сознание (эго), предсознание (суперэго) и область бессознательного (ид). Он описал, как взаимодействуют эти уровни. Тем не менее, многие по праву считают родоначальником соционики К.Г. Юнга - швейцарского психолога, ученика и соратника Фрейда - который в результате своей многолетней психологической практики выделил и описал восемь так называемых психологических типов. О том, как Юнг пришел к открытию типов подробнее читайте в разделе Как появились типы. Юнг впервые ввел в практику такие понятия как экстраверсия и интроверсия. Он заметил, что одни люди более открыты, общительны, доступны, их интерес как бы направлен во внешний мир (их он назвал экстравертами), а другие напротив, замкнуты, сдержанны, недоступны, их интерес направлен на свой внутренний мир (это интроверты).
Наука » Психология » Соционика
Почему люди хотят жить дружно, но при этом постоянно ссорятся? Как выбрать профессию по душе и преуспеть в ней? Как собрать психологически совместимую команду и добиться наилучших результатов? Как найти себе спутника жизни? Как строить отношения с деловыми партнерами?
Это лишь немногие из вопросов, которыми занимается молодая наука соционика. Она уже завоевала огромную популярность в самых широких кругах, и популярность ее постоянно растет. Что же такое соционика? Если говорить коротко, то соционика - это наука, изучающая информационную психологию общения. Предметом изучения соционики являются так называемые психологические типы и отношения между ними (а в конечном итоге и конкретные люди, которые являются носителями этих типов). Соционика доказала, что существует 16 типов личности и установила законы, по которым они взаимодействуют друг с другом.
Ответ на этот вопрос даёт математический расчёт. Пептид, состоящий из двух разных аминокислот А и В, в зависимости от порядка их расположения может иметь только 2 изомерные формы — АВ и ВА. У пептида из трёх аминокислот А, В и С уже до 6 изомерных форм (ABC, ACB, ВАС, ВСА, CAB, CBA), а у пептида из четырёх различных аминокислот — 24 изомера. Если же в составе пептида 20 разных аминокислот, число возможных изомеров составит примерно 2•1018!
Аминокислоты, как правило, имеют исторические названия — по источнику, из которого они впервые были выделены. Например, аспарагин обнаружили в 1806 г. в соке аспарагуса (спаржи), а глутаминовую (от лат. gluten — «клей») кислоту — в клейковине пшеницы. Цистеин (от греч. «цистис» — «пузырь») был впервые выделен в 1810 г. из камней мочевого пузыря. При изучении молочного белка казеина был открыт тирозин (от греч. «тирос» — «сыр»). Аргинин (от лат. argentum — «серебро») был впервые получен в виде соли серебра. Глицин назван так за сладкий вкус (от греч. «гликис» — «сладкий»). Название «лейцин» произошло от греческого слова «лейкос» — «белый»: в яичном белке это одна из самых распространённых аминокислот. Лизин получил своё название от одного из значений греческого слова «лизис» — «растворение», «разрушение», благодаря очень хорошей растворимости в воде. Некоторые аминокислоты были получены из белков шёлкового волокна, например гистидин (от греч. «гистос» — «ткань») и серии (от лат. sericus— «шёлковый»).
В начале 50-х гг. XX в. американские химики Лайнус Карл Полинг (1901 — 1994), награждённый Нобелевской премией за исследования природы химической связи, и Роберт Кори
*Молекулярную массу белков иногда выражают в дальтонах (Да). Дальтон — это единица массы, тождественная углеродной единице.
Лайнус Карл Полинг.
При гидролизе белков до аминокислот (разрушении пептидной связи водой) теряется информация о последовательности их соединения. Поэтому долгое время считали, что определение первичной структуры белка представляет собой совершенно безнадежную задачу. Но в 50-х гг. XX в. английский биохимик Фредерик Сенгер (родился в 1918 г.) смог расшифровать последовательность аминокислот в полипептидных цепях гормона инсулина. За эту работу, на выполнение которой ушло несколько лет, в 1958 г. Сенгер был удостоен Нобелевской премии по химии (двадцатью годами позже он совместно с У. Гилбертом получил вторую премию за вклад в установление первичной структуры ДНК).
Принципы определения аминокислотной последовательности, впервые сформулированные Сенгером, используются и ныне, правда, со всевозможными вариациями и усовершенствованиями. Процедура установления первичной структуры белка сложна и многоступенчата: в ней около десятка различных стадий. Сначала белок расщепляют до отдельных аминокислот и устанавливают их тип и количество в данном веществе. На следующей стадии длинную белковую молекулу расщепляют уже не полностью, а на фрагменты. Затем в этих фрагментах определяют порядок соединения аминокислот, последовательно отделяя их одну за другой. Расцепление белка на фрагменты проводят несколькими способами, чтобы в разных фрагментах были перекрывающиеся участки. Выяснив порядок расположения аминокислот во всех фрагментах, получают полную информацию о том, как аминокислоты расположены в белке. К концу XX в. созданы специальные приборы, определяющие последовательность аминокислот в молекуле белка в автоматическом режиме — секвенаторы (от англ. sequence — «последовательность»).
D- и L-формы аминокислот обладают способностью очень медленно превращаться друг в друга. За определённый (весьма длительный) период времени чистая D- или L-форма может стать смесью равных количеств обеих форм. Такая смесь называется рацематом, а сам процесс — рацемизацией. Скорость рацемизации зависит от температуры и типа аминокислоты. Данное свойство можно использовать для определения возраста ископаемых остатков организмов, а при необходимости — и живых существ. Например, в белке дентина (дентин — костная ткань зубов) L-a-парагиновая кислота самопроизвольно рацемизуется со скоростью 0,1% в год. У детей в период формирования зубов в дентине содержится только L-аспарагиновая кислота. Дентин выделяют из зуба и определяют в нём содержание D-формы. Результаты теста достаточно точны. Так, для 97-летней женщины, возраст которой был документально засвидетельствован, тест показал возраст 99 лет. Данные исследований, выполненных на ископаемых остатках доисторических животных — слонов, дельфинов, медведей, — хорошо согласуются с результатами датирования, полученными радионуклидным методом.
* Приведена формула для всей аминокислоты.
** R-группа глицина представляет собой просто атом водорода, и эту аминокислоту трудно отнести к какому-нибудь из четырех классов. Такая боковая группа не может нести ни положительный, ни отрицательный заряд, не способна участвовать во взаимодействиях неполярных R-групп (гидрофобных взаимодействиях) или образовании водородных связей. Но у глицина, входящего в состав аминокислотной цепочки, как и у всех других аминокислот, есть две полярные группы — >С=О и >N—Н. Поэтому глицин условно можно отнести к полярным аминокислотам.
В каждой молекуле аминокислоты есть атом углерода, связанный с четырьмя заместителями. Один из них — атом водорода, второй — карбоксильная группа —СООН. Она легко «отпускает на волю» ион водорода Н+, благодаря чему в названии аминокислот и присутствует слово «кислота». Третий заместитель — аминогруппа —NH2, и, наконец, четвёртый заместитель — группа атомов, которую в общем случае обозначают R. У всех аминокислот R-группы разные, и каждая из них играет свою, очень важную роль.
Свойства «бусинок», отличающие одну аминокислоту от другой, скрыты в R-группах (их ещё называют боковыми цепями). Что же касается группы —СООН, то химики-органики относятся к ней с большим почтением: всем другим атомам углерода в молекуле даются обозначения в зависимости от степени их удалённости от карбоксильной группы. Ближайший к ней атом именуют a-атомом, второй — b-атомом, следующий — g-атомом и т. д. Атом углерода в аминокислотах, который находится ближе всех к карбоксильной группе, т. е. a-атом, связан также с аминогруппой, поэтому природные аминокислоты, входящие в состав белка, называют a-аминокислотами.
Молекула белка очень длинная. Химики называют такие молекулы полимерными (от греч. «поли» — «много» и «мерос» — «часть», «доля»). Действительно, длинная молекула полимера состоит из множества маленьких молекул, связанных друг с другом. Так нанизываются на нить бусинки в ожерелье. В полимерах роль нити играют химические связи между бусинками-молекулами.
Секрет белков спрятан в особенностях этих самых бусинок. Большинство полимеров не принимает устойчивой формы в пространстве, уподобляясь тем же бусам, у которых и не может быть пространственной структуры: повесишь их на шею — они примут форму кольца или овала, положишь в коробку — свернутся в клубок неопределённой формы. А теперь представим себе, что некоторые бусинки могут «слипаться» друг с другом. Например, красные притягиваются к жёлтым. Тогда вся цепочка примет определённую форму, обязанную своим существованием «слипанию» жёлтых и красных бусинок.
Более 4 млрд. лет назад на Земле из маленьких неорганических молекул непостижимым образом возникли белки, ставшие строительными блоками живых организмов. Своим бесконечным разнообразием всё живое обязано именно уникальным молекулам белка, и иные формы жизни во Вселенной науке пока неизвестны.
Разнообразие функций, выполняемых встречающимися в природе белками, огромно.
Белки, или протеины (от греч. «протос» — «первый»), — это природные органические соединения, которые обеспечивают все жизненные процессы любого организма. Из белков построены хрусталик глаза и паутина, панцирь черепахи и ядовитые вещества грибов... С помощью белков мы перевариваем пищу и боремся с болезнями. Благодаря особым белкам по ночам светятся светлячки, а в глубинах океана мерцают таинственным светом медузы.
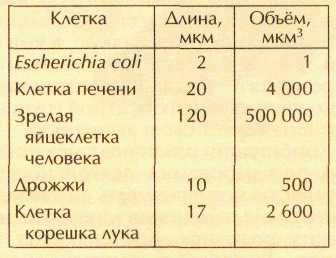
Очень давно, приблизительно 1,5 млрд. лет назад, природа совершила скачок в развитии — произошёл переход от маленьких клеток с простой структурой к большим по размерам и значительно сложнее устроенным клеткам. Эти высокоорганизованные клетки называют эукариотическими (от греч. «эу» — «хорошо», «полностью» и «карион» — «ядро ореха»). Высшие организмы в отличие от бактерий состоят из эукариотических клеток. Сравнить размеры прокариотических и эукариотических клеток можно с помощью таблицы: