Оксид углерода(II), или угарный газ, СО был открыт английским химиком Джозефом Пристли в 1799 г. Это бесцветный газ без вкуса и запаха, он малорастворим в воде (3,5 мл в 100 мл воды при 0 °С), имеет низкие температуры плавления (-205 °С) и кипения (-192 °С).
В атмосферу Земли угарный газ попадает при неполном сгорании органических веществ, при извержении вулканов, а также в результате жизнедеятельности некоторых низших растений (водорослей). Естественный уровень СО в воздухе составляет 0,01—0,9 мг/м3. Угарный газ очень ядовит. В организме человека и высших животных он активно реагирует с
Пламя горящего угарного газа — красивого сине-фиолетового цвета. Его легко наблюдать самому. Для этого надо зажечь спичку. Нижняя часть пламени светящаяся — этот цвет придают ему раскалённые частицы углерода (продукта неполного сгорания древесины). Сверху пламя окружено сине-фиолетовой каймой. Это горит образующийся при окислении древесины угарный газ.
комплексным соединением железа — гемом крови (связанным с белком глобином), нарушая функции переноса и потребления кислорода тканями. Помимо этого, он вступает в необратимое взаимодействие с некоторыми ферментами, участвующими в энергетическом обмене клетки. При концентрации угарного газа в помещении 880 мг/м3 смерть наступает через несколько часов, а при 10 г/м3 — практически мгновенно. Предельно допустимое содержание угарного газа в воздухе — 20 мг/м3. Первыми признаками отравления СО (при концентрации 6—30 мг/м3) являются снижение чувствительности зрения и слуха, головная боль, изменение частоты сердечных сокращений. Если человек отравился угарным газом, его надо вывести на свежий воздух, сделать ему искусственное дыхание, в лёгких случаях отравления — дать крепкого чаю или кофе.
Большие количества оксида углерода (II) поступают в атмосферу в результате деятельности человека. Так, автомобиль в среднем за год выбрасывает в воздух около 530 кг СО. При сжигании в двигателе внутреннего сгорания 1 л бензина выброс угарного газа колеблется от 1 50 до 800 г. На автострадах России средняя концентрация СО составляет 6—57 мг/м3, т. е. превышает порог отравления. Угарный газ накапливается в плохо проветриваемых дворах перед домами, расположенными вблизи автострад, в подвалах и гаражах. В последние годы на автодорогах организованы специальные пункты по контролю содержания угарного газа и других продуктов неполного сгорания топлива (СО-СН-контроль).
При комнатной температуре угарный газ довольно инертен. Он не взаимодействует с водой и растворами щелочей, т. е. является несолеобразующим оксидом, однако при нагревании вступает в реакцию с твёрдыми щелочами: СО+КОН=НСООК (формиат калия, соль муравьиной кислоты); СО+Са(ОН)2=СаСО3+Н2. Эти реакции применяют для выделения водорода из синтез-газа (СО+3Н2), образующегося при взаимодействии метана с перегретым водяным паром.
Интересным свойством угарного газа является его способность образовывать соединения с переходными металлами — карбонилы, например: Ni+4СО®70°CNi(CO)4.
Оксид углерода(II) — прекрасный восстановитель. При нагревании он окисляется кислородом воздуха: 2СО+О2=2СО2. Эту реакцию возможно осуществить и при комнатной температуре, используя катализатор — платину или палладий. Такие катализаторы устанавливают на автомобилях для уменьшения выброса СО в атмосферу.
При реакции СО с хлором образуется очень ядовитый газ фосген (tкип=7,6 °С): СО+Cl2=COCl2. Раньше его применяли в качестве боевого отравляющего вещества, а сейчас используют в производстве синтетических полимеров полиуретанов.
Угарный газ используют при выплавке чугуна и стали для восстановления железа из оксидов, он находит широкое применение и в органическом синтезе. При взаимодействии смеси оксида углерола(II) с водородом в зависимости от условий (температуры, давления) образуются различные продукты — спирты, карбонильные соединения, карбоновые кислоты. Особенно большое значение имеет реакция синтеза метанола: СО+2Н2=CH3OH, являющегося одним из основных продуктов органического синтеза. Угарный газ используют для синтеза фосгена, муравьиной кислоты, в качестве высококалорийного топлива.
В промышленности угарный газ получают газификацией твёрдого топлива (кокса) — взаимодействием его с кислородом и перегретым водяным паром: С+О2«СО2; СО2+С«2СО и С+Н2О«СО+Н2. В лаборатории для получения угарного газа производят обезвоживание органических кислот — муравьиной и щавелевой, действуя на них концентрированной серной кислотой:
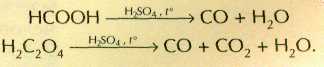

Похожие статьи