Непредельные углеводороды содержат одну или несколько кратных углерод-углеродных связей. Соединения с одной двойной связью в молекуле — алкены (олефины). Подобно алканам, они образуют гомологический ряд, простейший представитель которого — этилен С2Н4 (этен).
Помимо изомерии углеродного скелета для алкенов возможна изомерия положения кратной связи и геометрическая цис-транс-изомерия (см. статью «Почему их так много?»).

Горение парафиновой свечи.
Двойная связь в алкенах состоит из прочной s-связи и более диффузной (размытой) p-связи, открытой для многих атак. В целом кратная связь представляет собой область повышенной электронной плотности, которая доступна для частиц с полным или частичным положительным зарядом — электрофилов (от греч. «электрон» и «филос» — «любящий»). Именно этим объясняется высокая реакционная способность алкенов: они легко вступают в реакции присоединения по кратной связи, протекающие по ионному (электрофильному) механизму. Так, молекула Вr2, приближаясь к системе p-электронов этилена, поляризуется: в ней происходит частичное разделение зарядов Brd+— Brd-, при этом связь между атомами брома в молекуле ослабляется. Атом брома, несущий частичный положительный заряд, присоединяется к молекуле этилена. В результате возникает положительно заряженный карбониевый ион (карбокатион), который затем вступает в реакцию с анионом Вr- с образованием 1,2-дибромэтана:
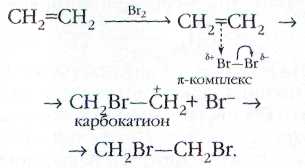
Аналогичным образом к алкенам присоединяются галогеноводороды, вода, спирты. Русский учёный Владимир Васильевич Марковников (1837— 1904) установил закономерность, известную как правило Марковникова: в реакциях алкенов с различными реагентами Н—X (где X — это Сl, Вr, ОН, OR) водород присоединяется к тому атому углерода при двойной связи, с которым связано больше атомов водорода, например:
Правило Марковникова объясняется механизмом реакции: из двух карбокатионов, которые могут образоваться на первой стадии процесса — вторичного СН3—СН+—СН3 и первичного СН3—СН2—СН2+, наиболее устойчивым будет вторичный. Это вызвано тем, что в нём в частичной компенсации положительного заряда участвуют две алкильные группы, а не одна. Однако при наличии в алкене электроноакцепторного заместителя (функциональной группы, оттягивающей на себя электронную плотность) более стабильным оказывается первичный карбокатион, и правило Марковникова не выполняется: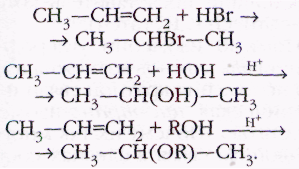
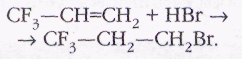
Это так называемое антимарковниковское присоединение.
В присутствии пероксидов или на свету бромоводород всегда присоединяется к алкенам против правила Марковникова — по радикальному, а не ионному механизму.
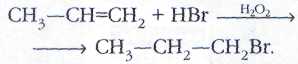
При нагревании в газовой фазе, а также на свету взаимодействовать с алкенами по радикальному механизму, не затрагивая двойную связь, могут хлор и бром:
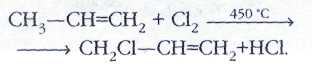
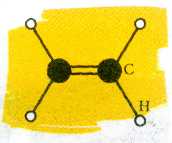
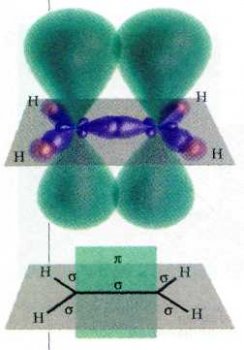
Строение молекулы этилена.
Cuстема s- и p-связей в молекуле этилена.
н-Октен, н-нонен, н-ундецен.
*Общая формула гомологического ряда алкенов: СnН2n Низшие алкены (этилен, пропилен, бутены) при комнатной температуре — газы, начиная с пентенов — жидкости, а высшие алкены — твёрдые вещества.
**Современные номенклатурные наименования алкенов должны звучать так: этен, пропен, бутен и т. д. Однако для С2Н4 и С3Н6 сохранены их традиционные названия — этилен и пропилен.
Эту реакцию подробно исследовал русский химик Михаил Дмитриевич Львов (1848—1899).
Простейшие алкены — ценное химическое сырьё. Окислением этилена получают уксусный альдегид:
и уксусную кислоту:
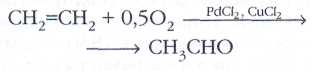
а его гидратацией — этиловый спирт:
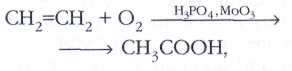
Было установлено, что этилен ускоряет созревание плодов, именно поэтому он часто используется в теплицах и овощехранилищах. Большие объёмы этилена и пропилена расходуются на производство полимерных материалов, таких как полиэтилен и полипропилен.


Похожие статьи