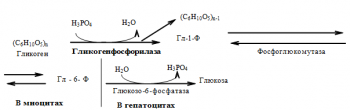
Схема фосфоролиза гликогена
Распад гликогена в мышцах происходит при мышечных сокращениях, а в печени — при голодании и в перерывах между приёмами пищи. Основной механизм гликогенолиза — фосфоролиз (расщепление -1,4-гликозидных связей с участием фосфорной кислоты и гликогенфосфорилазы).
Различия гликогенолиза в печени и мышцах. В гепатоцитах есть фермент глюкозо-6- фосфатаза и образуется свободная глюкоза, которая поступает в кровь. В миоцитах нет глюкозо-6-фосфатазы. Образовавшийся глюкозо-6-фосфат не может выйти из клетки в кровь (фосфорилированная глюкоза не проходит цитоплазматическую мембрану) и используется на нужды миоцитов.
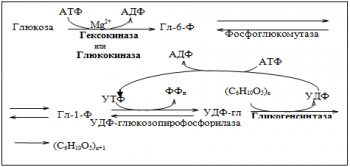
Схема синтеза гликогена
Общее содержание гликогена в организме взрослого человека около 450 г (в печени —
до 150 г, в мышцах — около 300 г). Более интенсивно гликогенез осуществляется в печени.
Гликогенсинтаза — ключевой фермент процесса — катализирует присоединение глюкозы к молекуле гликогена с образованием -1,4-гликозидных связей.
Существует группа белков-переносчиков глюкозы (ГЛЮТ), сходных по структуре, но различающихся по участию в транспорте глюкозы (пять изоформ собственных транспортеров глюкозы). Они локализованы в плазматических мембранах всех клеток и участвуют в транспорте глюкозы (ускоряют транспорт) по градиенту её концентрации.
Инсулин стимулирует поступление глюкозы в адипоциты, миоциты и кардиомиоциты, увеличивая количество ГЛЮТ 4 в плазматических мембранах этих клеток.
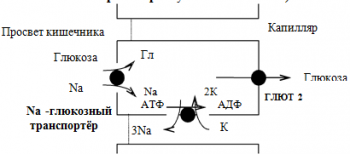
Всасывание глюкозы происходит в два этапа. I этап — транспорт глюкозы из полости тонкого кишечника в энтероциты. Осуществляется по двум механизмам:
натрий-независимый транспорт с участием ГЛЮТ 5;
натрий-зависимый транспорт с участием Na -глюкозного транспортёра.
2 этап — транспорт глюкозы из энтероцитов в капилляры портальной венозной системы (натрий-независимый транспорт с участием ГЛЮТ 2).
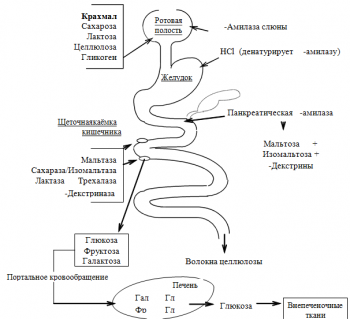
Ротовая полость. -Амилаза слюны гидролизует внутренние -1,4-гликозидные связи. Продуктами пищеварения являются олигосахаридные фрагменты (декстрины), в небольшом количестве — мальтоза и глюкоза.
Тонкий кишечник. Секретин стимулирует выделение панкреатического сока.
Холецистокинин-панкреозимин стимулирует секрецию панкреатической - амилазы и других панкреатических ферментов пищеварения.
Панкреатическая - амилаза гидролизует внутренние - 1,4-гликозидные связи олигосахаридов и полисахаридов до мальтозы, изомальтозы и - декстринов.
Углеводы — альдегиды и кетоны многоатомных спиртов, а также производные и полимеры этих соединений.
Углеводы пищи. Большая часть углеводов поступает в организм с пищей растительного происхождения. Обычный суточный рацион содержит 400–500 г углеводов, из которых 60–80 % составляют полисахариды (в основном крахмал, в меньшем количестве — гликоген и пищевые волокна), 20–30 % олигосахариды (сахароза, лактоза, мальтоза), остальное количество — моносахариды (в основном глюкоза, фруктоза и пентозы). Углеводы обеспечивают 60–70 % (не менее 50 %) суточного энергопотребления. В кишечнике всасываются моносахариды, поэтому в процессе переваривания углеводов пищи должно происходить их расщепление до моносахаридов.
Углеводы пищи. Большая часть углеводов поступает в организм с пищей растительного происхождения. Обычный суточный рацион содержит 400–500 г углеводов, из которых 60–80 % составляют полисахариды (в основном крахмал, в меньшем количестве — гликоген и пищевые волокна), 20–30 % олигосахариды (сахароза, лактоза, мальтоза), остальное количество — моносахариды (в основном глюкоза, фруктоза и пентозы). Углеводы обеспечивают 60–70 % (не менее 50 %) суточного энергопотребления. В кишечнике всасываются моносахариды, поэтому в процессе переваривания углеводов пищи должно происходить их расщепление до моносахаридов.
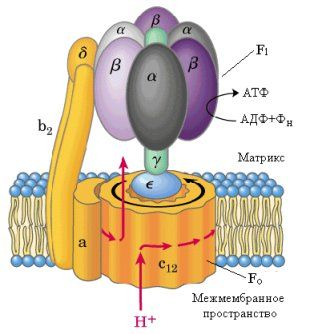
Ι. НАДН-убихинон-оксидоредуктаза. Принимает электроны и протоны от НАДН•Н+;
протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.
Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью.
Ι. НАДН-убихинон-оксидоредуктаза. Принимает электроны и протоны от НАДН•Н+;
протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.
Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью.
протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.
Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью.
Ι. НАДН-убихинон-оксидоредуктаза. Принимает электроны и протоны от НАДН•Н+;
протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.

Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью.
Большая часть кислорода, потребляемого клеткой (около 80 %), используется, как указано, в митохондриях с участием цитохромоксидазы. Это так называемый оксидазный путь. При этом происходит полное восстановление кислорода, причем субстрат не реагирует с кислородом непосредственно. Данный путь дает клетке энергию в виде АТФ. Помимо цитохромоксидазы существуют другие оксидазы (ФМН и ФАД-зависимые), которые катализируют реакции окисления веществ с образованием перекиси водорода.
Наряду с этим существует другой путь окисления – оксигеназный. Он не дает клетке энергии, кислород включается в субстрат с образованием новой гидроксильной или карбоксильной группы. Этот путь происходит в основном в мембранах эндоплазматического ретикулума (микросомах). Путем микросомного окисления осуществляется α- и ω- окисление жирных кислот, синтез ненасыщенных жирных кислот, стероидов. Таким путем обезвреживаются ксенобиотики, т. е. чужеродные для организма вещества (лекарства, ядохимикаты, косметические препараты). Ферменты, осуществляющие такое окисление, называются оксигеназами. Различают диоксигеназы, которые включают в молекулу субстрата два атома молекулы кислорода. Более распространены в клетках монооксигеназы (гидроксилазы). Они катализируют реакции, при которых в молекулу субстрата включается один атом из молекулы кислорода, второй же атом кислорода восстанавливается при этом до воды. Монооксигеназные системы представляют собой короткие цепи переноса электронов и протонов, источником которых служит чаще всего восстановленный НАДФ+, реже НАД+ или аскорбиновая кислота. Активатором кислорода при этом является цитохром Р450 – одноцепочечный хромопротеин с молекулярной массой 50 кДа.
Наряду с этим существует другой путь окисления – оксигеназный. Он не дает клетке энергии, кислород включается в субстрат с образованием новой гидроксильной или карбоксильной группы. Этот путь происходит в основном в мембранах эндоплазматического ретикулума (микросомах). Путем микросомного окисления осуществляется α- и ω- окисление жирных кислот, синтез ненасыщенных жирных кислот, стероидов. Таким путем обезвреживаются ксенобиотики, т. е. чужеродные для организма вещества (лекарства, ядохимикаты, косметические препараты). Ферменты, осуществляющие такое окисление, называются оксигеназами. Различают диоксигеназы, которые включают в молекулу субстрата два атома молекулы кислорода. Более распространены в клетках монооксигеназы (гидроксилазы). Они катализируют реакции, при которых в молекулу субстрата включается один атом из молекулы кислорода, второй же атом кислорода восстанавливается при этом до воды. Монооксигеназные системы представляют собой короткие цепи переноса электронов и протонов, источником которых служит чаще всего восстановленный НАДФ+, реже НАД+ или аскорбиновая кислота. Активатором кислорода при этом является цитохром Р450 – одноцепочечный хромопротеин с молекулярной массой 50 кДа.
Первый фермент цитратсинтаза ингибируется АТФ, жирными кислотами. Лимитирующим ферментом (катализирует самую медленную реакцию) является изоцитратДГ. Он активируется АДФ, НАД+, ингибируется АТФ, восстановленной формой НАДН•Н+. Когда в клетке достаточно АТФ (покой), скорость цикла снижается, при распаде же АТФ образуется АДФ, который активирует самую медленную реакцию и, следовательно, скорость всего цикла в целом.
Познакомившись с центральными путями метаболизма, основное назначение которых — отделение от субстратов атомов водорода, проследим за судьбой этих атомов, за тем, как происходит их окисление кислородом до воды.
Познакомившись с центральными путями метаболизма, основное назначение которых — отделение от субстратов атомов водорода, проследим за судьбой этих атомов, за тем, как происходит их окисление кислородом до воды.
1.Водороддонорная функция. Цикл Кребса поставляет субстраты для дыхательной цепи (НАД-зависимые субстраты: изоцитрат, -кетоглутарат, малат; ФАД-зависимый субстрат – сукцинат).
2.Катаболическая функция. В ходе ЦТК окисляются до конечных продуктов обмена
ацетильные остатки, образовавшиеся из топливных молекул (глюкоза, жирные кислоты, глицерол, аминокислоты).
3.Анаболическая функция. Субстраты ЦТК являются основой для синтеза многих молекул (кетокислоты — α-кетоглутарат и ЩУК — могут превращаться в аминокислоты глу и асп; ЩУК может превращаться в глюкозу, сукцинил-КоА используется на синтез гема).
2.Катаболическая функция. В ходе ЦТК окисляются до конечных продуктов обмена
ацетильные остатки, образовавшиеся из топливных молекул (глюкоза, жирные кислоты, глицерол, аминокислоты).
3.Анаболическая функция. Субстраты ЦТК являются основой для синтеза многих молекул (кетокислоты — α-кетоглутарат и ЩУК — могут превращаться в аминокислоты глу и асп; ЩУК может превращаться в глюкозу, сукцинил-КоА используется на синтез гема).
Для скрининг-диагностики — выборочные тесты.
Для диагностики заболеваний (аспарагиновая трансаминаза — для диагностики инфаркта миокарда, аланиновая трансаминаза — для диагностики заболеваний печени).
Для дифференциальной диагностики (кислая фосфатаза — рак предстательной железы, щелочные фосфатазы — костная ткань, метастазы рака).
Для лечения заболеваний:
а) заместительная терапия (при заболеваниях ЖКТ используют пепсин, панкреатин, фестал, панзинорм, мезим-форте — это гидролитические ферменты; при панкреатите могут использоваться ингибиторы ферментов);
б) для лечения заболеваний и устранения патологических процессов используют ферменты с целью:
Для диагностики заболеваний (аспарагиновая трансаминаза — для диагностики инфаркта миокарда, аланиновая трансаминаза — для диагностики заболеваний печени).
Для дифференциальной диагностики (кислая фосфатаза — рак предстательной железы, щелочные фосфатазы — костная ткань, метастазы рака).
Для лечения заболеваний:
а) заместительная терапия (при заболеваниях ЖКТ используют пепсин, панкреатин, фестал, панзинорм, мезим-форте — это гидролитические ферменты; при панкреатите могут использоваться ингибиторы ферментов);
б) для лечения заболеваний и устранения патологических процессов используют ферменты с целью:
В крови могут присутствовать следующие ферменты:
1)секреторные (плазмоспецифические) — печень;
2)экскреторные — желудочно-кишечный тракт;
3)клеточные — из клеток органов и тканей при некрозе, нарушении проницаемости клеточных мембран или усилении пролиферации клеток.
Активность ферментов в крови зависит от их активности в печени, мышцах, лейкоцитах, тромбоцитах.
На уровень ферментов в крови влияют:
1)их продолжительность жизни (скорость обновления); дольше всех «живут» ферменты костной ткани, мышц, ЦНС, меньше — ферменты эритроцитов, печени, жировой ткани, еще меньше — ферменты лейкоцитов и тромбоцитов;
2)градиент концентрации на границе органа, ткани и кровеносного сосуда;
3)размер молекул фермента: чем меньше размер, тем легче ферменты попадают в кровь;
4)внутриклеточная локализация: ферменты митохондрий и цитоплазмы.
1)секреторные (плазмоспецифические) — печень;
2)экскреторные — желудочно-кишечный тракт;
3)клеточные — из клеток органов и тканей при некрозе, нарушении проницаемости клеточных мембран или усилении пролиферации клеток.
Активность ферментов в крови зависит от их активности в печени, мышцах, лейкоцитах, тромбоцитах.
На уровень ферментов в крови влияют:
1)их продолжительность жизни (скорость обновления); дольше всех «живут» ферменты костной ткани, мышц, ЦНС, меньше — ферменты эритроцитов, печени, жировой ткани, еще меньше — ферменты лейкоцитов и тромбоцитов;
2)градиент концентрации на границе органа, ткани и кровеносного сосуда;
3)размер молекул фермента: чем меньше размер, тем легче ферменты попадают в кровь;
4)внутриклеточная локализация: ферменты митохондрий и цитоплазмы.