Тиреоидные гормоны оказывают влияние на фундаментальные физиологические процессы: клеточную дифференцировку, рост и метаболизм тканей.
В фолликулах щитовидной железы (ЩЖ) образуются 2 основных гормона: Т3 и Т4,
которые действуют на клетки через внутриклеточные ядерные (R).
Особенностью гормонов ЩЖ является присутствие в их молекуле йода. В основе их структуры лежит тирониновое ядро, состоящее из двух конденсированных молекул L- тирозина. В ядро могут включаться 3 или 4 атома йода: 3,5,3’,5'-тетрайодтиронин (Т4, тироксин) и 3,5,3'-трийодтиронин (Т3). Третье производное тиронина — 3,3',5-T3 — не обладает гормональной активностью. Это «обратный Т3». Несмотря на то что Т3 намного активнее, чем Т4, в ЩЖ синтезируется главным образом Т4. Трийодтиронин образуется из Т4 путём дейодирования последнего в периферических тканях. Т3 обладает на порядок более высоким сродством к (R) периферических тканей, чем Т4.
Синтез гормонов ЩЖ осуществляется в 4 этапа. Во-первых, включение йода в ЩЖ с помощью йодного насоса, в работе которого принимает участие Na+-K+-зависимая АТФ-аза. Во-вторых, синтез тиреоидных гормонов, который начинается с включения йода в молекулы тирозинов, входящих в состав тиреоглобулина. Тиреоглобулин — главный белок коллоида, заполняющего фолликулы. Процесс йодирования тирозинов осуществляется с помощью тиреопероксидазы и H2О2 и стимулируется ТТГ. В-третьих, конденсация моно- и дийодтиронинов с образованием Т3 из Т4 под влиянием тиреопероксидазы. По мере йодирования остатков тирозина молекулы тиреоглобулина перемещаются в просвет фолликула, где они накапливаются «про запас». В-четвертых, секреция гормонов, которые освобождаются из тиреоглобулина при участии гидролаз лизосом эпителиальных клеток.
В фолликулах щитовидной железы (ЩЖ) образуются 2 основных гормона: Т3 и Т4,
которые действуют на клетки через внутриклеточные ядерные (R).
Особенностью гормонов ЩЖ является присутствие в их молекуле йода. В основе их структуры лежит тирониновое ядро, состоящее из двух конденсированных молекул L- тирозина. В ядро могут включаться 3 или 4 атома йода: 3,5,3’,5'-тетрайодтиронин (Т4, тироксин) и 3,5,3'-трийодтиронин (Т3). Третье производное тиронина — 3,3',5-T3 — не обладает гормональной активностью. Это «обратный Т3». Несмотря на то что Т3 намного активнее, чем Т4, в ЩЖ синтезируется главным образом Т4. Трийодтиронин образуется из Т4 путём дейодирования последнего в периферических тканях. Т3 обладает на порядок более высоким сродством к (R) периферических тканей, чем Т4.
Синтез гормонов ЩЖ осуществляется в 4 этапа. Во-первых, включение йода в ЩЖ с помощью йодного насоса, в работе которого принимает участие Na+-K+-зависимая АТФ-аза. Во-вторых, синтез тиреоидных гормонов, который начинается с включения йода в молекулы тирозинов, входящих в состав тиреоглобулина. Тиреоглобулин — главный белок коллоида, заполняющего фолликулы. Процесс йодирования тирозинов осуществляется с помощью тиреопероксидазы и H2О2 и стимулируется ТТГ. В-третьих, конденсация моно- и дийодтиронинов с образованием Т3 из Т4 под влиянием тиреопероксидазы. По мере йодирования остатков тирозина молекулы тиреоглобулина перемещаются в просвет фолликула, где они накапливаются «про запас». В-четвертых, секреция гормонов, которые освобождаются из тиреоглобулина при участии гидролаз лизосом эпителиальных клеток.
Окситоцин и вазопрессин принято считать гормонами задней доли гипофиза, хотя они образуются и секретируются нейронами гипоталамуса. Эти нанопептиды схожи по строению. Свое название вазопрессин получил из-за способности повышать артериальное давление, а название «окситоцин» связано со способностью гормона ускорять роды.
Вазопрессин, помимо сосудосуживающего действия, обеспечивает сохранение воды в организме, стимулируя её реабсорбцию в почечных канальцах. Регулятором секреции гормона является изменение осмотического давления и объёма циркулирующей крови.
Окситоцин усиливает сокращение мышц матки во время родов, стимулирует лактацию, регулирует поведенческую активность, связанную с беременностью, лактацией и уходом за потомством. Обнаружено участие окситоцина в механизмах памяти. Главными стимулами высвобождения окситоцина являются эстрогены и нервные импульсы, возникающие при раздражении грудных сосков. Прогестерон ингибирует продукцию окситоцина. У мужчин окситоцин стимулирует семявыносящие протоки (эякуляцию), влияет на поведенческую активность, связанную с половой функцией.
Недостаточность вазопрессина проявляется в форме несахарного диабета, главными симптомами которого являются жажда и полиурия, но, в отличие от сахарного диабета, моча при недостаточности вазопрессина не имеет сладкого вкуса, а её удельный вес низкий
Вазопрессин, помимо сосудосуживающего действия, обеспечивает сохранение воды в организме, стимулируя её реабсорбцию в почечных канальцах. Регулятором секреции гормона является изменение осмотического давления и объёма циркулирующей крови.
Окситоцин усиливает сокращение мышц матки во время родов, стимулирует лактацию, регулирует поведенческую активность, связанную с беременностью, лактацией и уходом за потомством. Обнаружено участие окситоцина в механизмах памяти. Главными стимулами высвобождения окситоцина являются эстрогены и нервные импульсы, возникающие при раздражении грудных сосков. Прогестерон ингибирует продукцию окситоцина. У мужчин окситоцин стимулирует семявыносящие протоки (эякуляцию), влияет на поведенческую активность, связанную с половой функцией.
Недостаточность вазопрессина проявляется в форме несахарного диабета, главными симптомами которого являются жажда и полиурия, но, в отличие от сахарного диабета, моча при недостаточности вазопрессина не имеет сладкого вкуса, а её удельный вес низкий
Гормон роста (СТГ). Многие эффекты СТГ опосредуются соматомединами — тканевыми факторами, секретируемыми под влиянием гормона роста. Соматомедины- факторы сульфатирования усиливают использование сульфата и синтез коллагена хрящевой тканью; соматомедины-факторы роста (особенно схожие по строению с инсулин- рецепторными субстратами IRS-1 и IRS-2) активируют рост клеток и тканей.
Связываясь с IRS, гормон роста оказывает разнообразное влияние на метаболизм. Основное действие СТГ — обеспечить рост и развитие организма. Под влиянием гормона усиливается синтез белков и нуклеиновых кислот в костях, хрящах, мышцах, печени и других внутренних органах; ускоряется транспорт аминокислот внутрь клеток. Одновременно тормозится катаболизм белков, что проявляется снижением уровня остаточного азота и мочевины в крови, положительным азотистым балансом.
СТГ стимулирует липолиз. Образующаяся при этом энергия используется на процессы анаболизма. СТГ участвует в регуляции уровня глюкозы в крови — это «контринсулярный» гормон (он снижает использование глюкозы жировыми и мышечными клетками и активирует глюконеогенез в печени). Секреция СТГ увеличивается при преимущественно белковом питании и голодании, физических упражнениях, стрессе, сразу же после засыпания.
Избыточная секреция СТГ у детей и подростков приводит к развитию гигантизма (рост костей пропорционален). У взрослых избыток СТГ проявляется акромегалией (диспропорциональным ростом костей скелета, мягких тканей, внутренних органов).
Связываясь с IRS, гормон роста оказывает разнообразное влияние на метаболизм. Основное действие СТГ — обеспечить рост и развитие организма. Под влиянием гормона усиливается синтез белков и нуклеиновых кислот в костях, хрящах, мышцах, печени и других внутренних органах; ускоряется транспорт аминокислот внутрь клеток. Одновременно тормозится катаболизм белков, что проявляется снижением уровня остаточного азота и мочевины в крови, положительным азотистым балансом.
СТГ стимулирует липолиз. Образующаяся при этом энергия используется на процессы анаболизма. СТГ участвует в регуляции уровня глюкозы в крови — это «контринсулярный» гормон (он снижает использование глюкозы жировыми и мышечными клетками и активирует глюконеогенез в печени). Секреция СТГ увеличивается при преимущественно белковом питании и голодании, физических упражнениях, стрессе, сразу же после засыпания.
Избыточная секреция СТГ у детей и подростков приводит к развитию гигантизма (рост костей пропорционален). У взрослых избыток СТГ проявляется акромегалией (диспропорциональным ростом костей скелета, мягких тканей, внутренних органов).
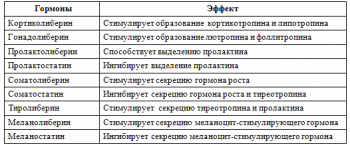
Нейроны гипоталамуса синтезируют гормоны и секретируют их в капиллярную сеть, доставляющую гормоны к клеткам гипофиза. Эти гормоны являются пептидами. Они делятся на: 1) гормоны, усиливающие (высвобождающие, либерины) секрецию и выделение соответствующих тропных гормонов передней доли гипофиза, и 2) угнетающие (ингибирующие, статины) эти процессы.
Витамин Д, ретиноевая кислота, стероидные и тиреоидные гормоны взаимодействуют непосредственно с внутриклеточными (R), поскольку они, будучи гидрофобными, свободно диффундируют через плазматическую мембрану. Эти рецепторы делятся на:
1) (R) стероидных гормонов (минералокортикоидов, андрогенов, прогестерона); 2) (R) тиреоидных гормонов (в том числе витамина Д и ретиноевой кислоты).
(R) стероидных гормонов находятся в цитозоле. Они образуют комплексы с белками теплового шока hsp (heat shock proteins), которые присоединяются к (R) таким образом, что закрывают его ДНК-связывающий домен. Кода гормон взаимодействует с (R), то белок- ингибитор hsp отделяется от (R), в результате чего (R) активируется. Активированный гормон-рецепторный комплекс перемещается в ядро, где он взаимодействует со строго определенными гормон-узнающими элементами ДНК (hormone response element).
(R) тиреоидных гормонов находятся в ядре в связанном с хроматином состоянии (за исключением рецепторов эстрогенов, которые в ядре образуют комплексы с hsp). После взаимодействия с гормоном изменяется конформация (R), что повышает его сродство к ДНК, т. е. (R) может связываться со специфическими генами в ядре, регулируя их экспрессию.
1) (R) стероидных гормонов (минералокортикоидов, андрогенов, прогестерона); 2) (R) тиреоидных гормонов (в том числе витамина Д и ретиноевой кислоты).
(R) стероидных гормонов находятся в цитозоле. Они образуют комплексы с белками теплового шока hsp (heat shock proteins), которые присоединяются к (R) таким образом, что закрывают его ДНК-связывающий домен. Кода гормон взаимодействует с (R), то белок- ингибитор hsp отделяется от (R), в результате чего (R) активируется. Активированный гормон-рецепторный комплекс перемещается в ядро, где он взаимодействует со строго определенными гормон-узнающими элементами ДНК (hormone response element).
(R) тиреоидных гормонов находятся в ядре в связанном с хроматином состоянии (за исключением рецепторов эстрогенов, которые в ядре образуют комплексы с hsp). После взаимодействия с гормоном изменяется конформация (R), что повышает его сродство к ДНК, т. е. (R) может связываться со специфическими генами в ядре, регулируя их экспрессию.
К 1-TMС-(R) относятся гуанилатциклазы, катализирующие образование цГМФ из ГТФ. Первый тип гуанилатциклаз, локализующийся в плазматической мембране, активируется внеклеточными лигандами (предсердным натрийуретическим фактором); второй —цитозольный фермент, активируемый оксидом азота (NO۬). Оксид азота вызывает расслабление гладкой мускулатуры сосудов, в том числе коронарных.
Гормон, присоединившись к 1-TMС-(R), его активирует. Этот гормон-рецепторный комплекс проявляет гуанилатциклазную активность, катализируя образование цГМФ из ГТФ. цГМФ (вторичный посредник) активирует протеинкиназу С, которая начинает фосфорилировать остатки Сер и Тре в белках-мишенях, что приводит эти белки в функционально активное состояние. цГМФ является также активатором фосфодиэстераз, катализирующих распад цАМФ (т. е. цГМФ и цАМФ – антагонисты). Конечный эффект цГМФ проявляется в изменении транспорта ионов и воды в почках и кишечнике; в сердечной мышце цГМФ способствует мышечному расслаблению; в палочках и колбочках сетчатки глаза цГМФ стимулирует открытие ионных каналов.
Гормон, присоединившись к 1-TMС-(R), его активирует. Этот гормон-рецепторный комплекс проявляет гуанилатциклазную активность, катализируя образование цГМФ из ГТФ. цГМФ (вторичный посредник) активирует протеинкиназу С, которая начинает фосфорилировать остатки Сер и Тре в белках-мишенях, что приводит эти белки в функционально активное состояние. цГМФ является также активатором фосфодиэстераз, катализирующих распад цАМФ (т. е. цГМФ и цАМФ – антагонисты). Конечный эффект цГМФ проявляется в изменении транспорта ионов и воды в почках и кишечнике; в сердечной мышце цГМФ способствует мышечному расслаблению; в палочках и колбочках сетчатки глаза цГМФ стимулирует открытие ионных каналов.
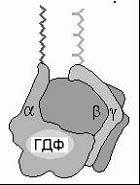
Первый этап действия гормона заключается во взаимодействии гормона с 7-ТМС-(R) (к ним относятся α- и β- адренергические (R), (R) гистамина, серотонина, соматостатина, гликопротеиновых гормонов, глюкагона, паратирина, кальцитонина, гормонов гипоталамуса).
Второй участник передачи гормонального сигнала — G-белки. Обнаружены: 1) большие, состоящие из нескольких субъединиц G-белки (связаны с мембранами); 2) низкомолекулярные, состоящие из одной полипептидной цепи (цитозольные). Все G-белки обладают ГТФ-азной активностью, и их конформация зависит от того, связаны ли они в данный момент с ГДФ или ГТФ. Мембранный G-белок состоит из 3 субъединиц: α, β и γ.
Гормоны — это класс регуляторных молекул, синтезируемых специальными клетками.
Особенности биологического действия: 1) низкая концентрация в крови (10–6–10–12 М);
2) обязательная связь с рецептором – (R), включающим каскадный механизм усиления гормонального сигнала; 3) изменение скорости синтеза ферментов или их активности; 4) регуляция секреции по принципу прямой и (или) обратной связи.
Взаимодействие гормона и (R) характеризуется высокой специфичностью, которая обеспечивается комплементарностью между структурой гормона и активного центра (R).
В результате эффекта кооперативности, возникающего при взаимодействии гормона и (R), существенно изменяется активность (R) — это есть феномен амплификации (усиления) гормонального сигнала. Механизм амплификации включает участие специальных ферментов и молекул — вторичных посредников. Гормональный сигнал способен «выключаться» в результате инактивирования (R) путём его фосфорилирования, либо удаления (R) с поверхности клетки (эндоцитоз) и т. д. Множество разных сигналов, воспринимаемых клеткой, суммируется в один определённый ответ.
Особенности биологического действия: 1) низкая концентрация в крови (10–6–10–12 М);
2) обязательная связь с рецептором – (R), включающим каскадный механизм усиления гормонального сигнала; 3) изменение скорости синтеза ферментов или их активности; 4) регуляция секреции по принципу прямой и (или) обратной связи.
Взаимодействие гормона и (R) характеризуется высокой специфичностью, которая обеспечивается комплементарностью между структурой гормона и активного центра (R).
В результате эффекта кооперативности, возникающего при взаимодействии гормона и (R), существенно изменяется активность (R) — это есть феномен амплификации (усиления) гормонального сигнала. Механизм амплификации включает участие специальных ферментов и молекул — вторичных посредников. Гормональный сигнал способен «выключаться» в результате инактивирования (R) путём его фосфорилирования, либо удаления (R) с поверхности клетки (эндоцитоз) и т. д. Множество разных сигналов, воспринимаемых клеткой, суммируется в один определённый ответ.
Фибринолиз — это процесс расщепления фибрина (фибриногена) на растворимые фрагменты (пептиды).
Основным звеном фибринолиза является плазминовая система. В плазминовую систему входят плазмин и его профермент — плазминоген, активаторы плазминогена, проактиваторы плазминогена, ингибиторы плазмина и ингибиторы активаторов плазминогена.
Плазмин обладает высокой специфичностью к фибрину и фибриногену. В результате действия плазмина фибрин (фибриноген) распадается на растворимые фрагменты (продукты деградации фибрина), которые затем удаляются из кровотока ретикулоэндоте-лиальной системой.
В плазме крови содержится плазминоген — неактивный предшественник плазмина.
Плазминоген — гликопротеин, синтезируемый в печени, костном мозге, почках. Превращение плазминогена в плазмин происходит в результате частичного протеолиза под действием активаторов плазминогена.
Активаторы плазминогена (АПГ). Существует большое количество АПГ, которые присутствуют в крови, других биологических жидкостях и тканях организма человека. Физиологические активаторы плазминогена классифицируются в зависимости от источника получения на тканевые (органные), сосудистые (тканевый активатор плазминогена), плазменные, кровяные, активатор из мочи — урокиназа, АПГ, выделяемые культурами раковых и трансформированных онкогенами клеток. Важнейший внешний активатор плазминогена — тканевый активатор плазминогена (тАПГ) — синтезируется эндотелиальными клетками кровеносных сосудов. Практически все АПГ продуцируются в виде проферментов (проактиваторов плазминогена).
Основным звеном фибринолиза является плазминовая система. В плазминовую систему входят плазмин и его профермент — плазминоген, активаторы плазминогена, проактиваторы плазминогена, ингибиторы плазмина и ингибиторы активаторов плазминогена.
Плазмин обладает высокой специфичностью к фибрину и фибриногену. В результате действия плазмина фибрин (фибриноген) распадается на растворимые фрагменты (продукты деградации фибрина), которые затем удаляются из кровотока ретикулоэндоте-лиальной системой.
В плазме крови содержится плазминоген — неактивный предшественник плазмина.
Плазминоген — гликопротеин, синтезируемый в печени, костном мозге, почках. Превращение плазминогена в плазмин происходит в результате частичного протеолиза под действием активаторов плазминогена.
Активаторы плазминогена (АПГ). Существует большое количество АПГ, которые присутствуют в крови, других биологических жидкостях и тканях организма человека. Физиологические активаторы плазминогена классифицируются в зависимости от источника получения на тканевые (органные), сосудистые (тканевый активатор плазминогена), плазменные, кровяные, активатор из мочи — урокиназа, АПГ, выделяемые культурами раковых и трансформированных онкогенами клеток. Важнейший внешний активатор плазминогена — тканевый активатор плазминогена (тАПГ) — синтезируется эндотелиальными клетками кровеносных сосудов. Практически все АПГ продуцируются в виде проферментов (проактиваторов плазминогена).
Антикоагулянтная система — это ряд ингибиторов свёртывания (антикоагулянтов), осуществляющих контроль скорости активирования факторов свёртывания и реакций между ними.
Практически каждому из участников процесса фибринообразования противостоят специфические ингибиторы. Многие антикоагулянты обладают антитромбиновым действием.
По механизму образования в организме все естественные (физиологические) антикоагулянты разделяют на первичные и вторичные. Первичные антикоагулянты постоянно синтезируются и с постоянной скоростью выделяются в кровоток. Первичные антикоагулянты ингибируют активные факторы коагуляции и не действуют на неактивные формы этих факторов. Вторичные антикоагулянты образуются из факторов свёртывания и других белков в процессе свёртывания крови, фибринолиза и активации других протеолитических систем.
Из физиологических антикоагулянтов функционально наиболее значимыми являются антитромбин III, гепарин, протеины С и S, 2-макроглобулин, липопротеин-ассоциированный коагуляционный ингибитор (ЛАКИ).
Практически каждому из участников процесса фибринообразования противостоят специфические ингибиторы. Многие антикоагулянты обладают антитромбиновым действием.
По механизму образования в организме все естественные (физиологические) антикоагулянты разделяют на первичные и вторичные. Первичные антикоагулянты постоянно синтезируются и с постоянной скоростью выделяются в кровоток. Первичные антикоагулянты ингибируют активные факторы коагуляции и не действуют на неактивные формы этих факторов. Вторичные антикоагулянты образуются из факторов свёртывания и других белков в процессе свёртывания крови, фибринолиза и активации других протеолитических систем.
Из физиологических антикоагулянтов функционально наиболее значимыми являются антитромбин III, гепарин, протеины С и S, 2-макроглобулин, липопротеин-ассоциированный коагуляционный ингибитор (ЛАКИ).
Назначение свёртывающей системы крови — образование нерастворимого фибрина. В свёртывающую систему крови входят ферментные и неферментные белки плазмы, тканей и форменных элементов крови (прежде всего тромбоцитов), надмолекулярные образования (фрагменты клеточных мембран) и ионизированный кальций. Международный комитет по выработке номенклатуры факторов свёртывания присвоил арабскую нумерацию тромбоцитарным (P1–11) и римскую (ф.I–XIII) — плазменным и тканевым факторам.
Большинство плазменных факторов гемокоагуляции являются ферментами (сериновые протеиназы), синтезируются в печени и секретируются в кровь в неактивном состоянии, то есть в виде прокоагулянтов. Активирование большинства прокоагулянтов осуществляется путём частичного протеолиза. На определённых этапах процесс свёртывания резко ускоряется неферментными белками (ф.VIII и ф.V), выполняющими роль коферментов.
Свёртывание крови (гемокоагуляция) — цепной каскадный ферментативный процесс, в ходе которого происходит взаимодействие и последовательная активация ряда сериновых протеиназ на фосфолипидных матрицах (тромбопластинах), заканчивающийся превращением растворимого фибриногена в нерастворимый фибрин.
Большинство плазменных факторов гемокоагуляции являются ферментами (сериновые протеиназы), синтезируются в печени и секретируются в кровь в неактивном состоянии, то есть в виде прокоагулянтов. Активирование большинства прокоагулянтов осуществляется путём частичного протеолиза. На определённых этапах процесс свёртывания резко ускоряется неферментными белками (ф.VIII и ф.V), выполняющими роль коферментов.
Свёртывание крови (гемокоагуляция) — цепной каскадный ферментативный процесс, в ходе которого происходит взаимодействие и последовательная активация ряда сериновых протеиназ на фосфолипидных матрицах (тромбопластинах), заканчивающийся превращением растворимого фибриногена в нерастворимый фибрин.
Система свёртывания крови по функциональному признаку делится на две системы: свёртывающую (гемокоагуляционную) и противосвёртывающую (антитромботическую). Противосвёртывающее действие обеспечивается антикоагулянтной и фибринолитической системами. Поддержание жидкого состояния циркулирующей крови обеспечивается взаимодействием свёртывающей и противосвёртывающей систем крови, которые в физиологических условиях находятся в динамическом равновесии.