По происхождению делятся на: 1) железистые; 2) лейкоцитарные; 3) микробные.
Лизоцим: бактерицидное действие основано на том, что он гидролизует гликозидную связь в гетерополисахаридах микробной оболочки и вызывает агрегацию бактерий, уменьшая их адгезию к поверхности зубов.
Пероксидазы: обязательное условие действия — наличие Н2О2 и анионов CNS‾ , Cl‾, из которых образуются ОCNS‾ и НОCl‾, действующие на аминокислоты микроорганизмов. Такие аминокислоты превращаются в токсичные альдегиды и оказывают повреждающее действие на микробы.
Нуклеазы — кислые и щелочные ДНКаза и РНКаза. Замедляют рост и размножение многих микроорганизмов в полости рта.
Десневая жидкость — это жидкое содержимое десневой бороздки. Представляет собой физиологическую среду сложного состава, содержащую лейкоциты, эпителий, микроорганизмы, электролиты, белки, ферменты. За сутки в ротовую полость поступает 0,5–2,5 мл десневой жидкости. В условиях здорового периодонта десневая жидкость — транссудат сыворотки крови, при поражении периодонта — экссудат, который образуется из-за повышения проницаемости сосудов и содержит продукты метаболизма бактерий и зубного налета.
Зубной ликвор — это жидкость, заполняющая свободные пространства всех зубных тканей. Включает в себя дентиновую и эмалевую (свободная вода эмали) жидкости. Именно через зубной ликвор и поступают все необходимые вещества для трофики зубных тканей. Белковый состав подобен белкам плазмы крови. В состав зубного ликвора входят и другие органические и неорганические молекулы. Дентиновая и эмалевая жидкости тесно связаны между собой: из дентиновой жидкости в эмалевую фильтруются различные вещества.
Лизоцим: бактерицидное действие основано на том, что он гидролизует гликозидную связь в гетерополисахаридах микробной оболочки и вызывает агрегацию бактерий, уменьшая их адгезию к поверхности зубов.
Пероксидазы: обязательное условие действия — наличие Н2О2 и анионов CNS‾ , Cl‾, из которых образуются ОCNS‾ и НОCl‾, действующие на аминокислоты микроорганизмов. Такие аминокислоты превращаются в токсичные альдегиды и оказывают повреждающее действие на микробы.
Нуклеазы — кислые и щелочные ДНКаза и РНКаза. Замедляют рост и размножение многих микроорганизмов в полости рта.
Десневая жидкость — это жидкое содержимое десневой бороздки. Представляет собой физиологическую среду сложного состава, содержащую лейкоциты, эпителий, микроорганизмы, электролиты, белки, ферменты. За сутки в ротовую полость поступает 0,5–2,5 мл десневой жидкости. В условиях здорового периодонта десневая жидкость — транссудат сыворотки крови, при поражении периодонта — экссудат, который образуется из-за повышения проницаемости сосудов и содержит продукты метаболизма бактерий и зубного налета.
Зубной ликвор — это жидкость, заполняющая свободные пространства всех зубных тканей. Включает в себя дентиновую и эмалевую (свободная вода эмали) жидкости. Именно через зубной ликвор и поступают все необходимые вещества для трофики зубных тканей. Белковый состав подобен белкам плазмы крови. В состав зубного ликвора входят и другие органические и неорганические молекулы. Дентиновая и эмалевая жидкости тесно связаны между собой: из дентиновой жидкости в эмалевую фильтруются различные вещества.
1. 99 % F в виде фторапатита входит в состав костей и зубов, придает им прочность и кислотоустойчивость.
2. Стимулирует реминерализацию костей и зубов (поступление в них кальция и фосфора).
3. Стимулирует синтез костной ткани, иммунитет (в том числе полости рта), гемопоэз.
4. Блокирует енолазу микроорганизмов (прекращается синтез лактата, который снижает рН ротовой жидкости) и синтез микроорганизмами внеклеточных полисахаридов.
5. Изменяет электрический потенциал поверхности эмали и препятствует адгезии бактерий к эмали.
Концентрация F выражается в мг/л и ppm (parts per million): 1 мг/л = 1 ppm; 1 % = 10000 ppm.
Рекомендации Всемирной организации здравоохранения (ВОЗ), 1994 г.:
за оптимум принято количество F, приближающееся к 4 мг/сут (1,5–4 мг/сут);
1,2 мг F — из воды (30 %); 2,0 мг — из пищи (50 %); 0,8 мг — из воздуха (20 %);
в жарких странах F в воде должно быть 0,5–0,8 мг/л, с умеренным климатом — 0,8– 1,0 мг/л, в северных — 1,0–1,2 мг/л.
Больше всего F в морепродуктах, зеленом и черном чае, красном вине. Много F в районах комбинатов по выпуску фосфорных удобрений, сжигания каменного угля.
2. Стимулирует реминерализацию костей и зубов (поступление в них кальция и фосфора).
3. Стимулирует синтез костной ткани, иммунитет (в том числе полости рта), гемопоэз.
4. Блокирует енолазу микроорганизмов (прекращается синтез лактата, который снижает рН ротовой жидкости) и синтез микроорганизмами внеклеточных полисахаридов.
5. Изменяет электрический потенциал поверхности эмали и препятствует адгезии бактерий к эмали.
Концентрация F выражается в мг/л и ppm (parts per million): 1 мг/л = 1 ppm; 1 % = 10000 ppm.
Рекомендации Всемирной организации здравоохранения (ВОЗ), 1994 г.:
за оптимум принято количество F, приближающееся к 4 мг/сут (1,5–4 мг/сут);
1,2 мг F — из воды (30 %); 2,0 мг — из пищи (50 %); 0,8 мг — из воздуха (20 %);
в жарких странах F в воде должно быть 0,5–0,8 мг/л, с умеренным климатом — 0,8– 1,0 мг/л, в северных — 1,0–1,2 мг/л.
Больше всего F в морепродуктах, зеленом и черном чае, красном вине. Много F в районах комбинатов по выпуску фосфорных удобрений, сжигания каменного угля.
1. Гомеостатическая. Поддерживает постоянный состав крови (гомеостаз). Питательные вещества в желудочно-кишечном тракте всасываются периодически. Их концентрации в портальном кровотоке в разные периоды времени существенно различаются, но благодаря гомеостатической функции печени концентрации важнейших метаболитов в большом круге кровообращения практически постоянны.
2. Роль печени в обмене белков. Освобождающиеся в процессе пищеварения аминокислоты попадают с током крови в печень и используются для:
синтеза белков плазмы крови (альбуминов, глобулинов, факторов свёртывания крови); образования α-кетокислот путём трансаминирования или окислительного дезаминирования аминокислот;
глюконеогенеза;
синтеза кетоновых тел;
получения энергии, подвергаясь превращениям в цикле трикарбоновых кислот;
синтеза мочевины;
синтеза креатина, холина.
2. Роль печени в обмене белков. Освобождающиеся в процессе пищеварения аминокислоты попадают с током крови в печень и используются для:
синтеза белков плазмы крови (альбуминов, глобулинов, факторов свёртывания крови); образования α-кетокислот путём трансаминирования или окислительного дезаминирования аминокислот;
глюконеогенеза;
синтеза кетоновых тел;
получения энергии, подвергаясь превращениям в цикле трикарбоновых кислот;
синтеза мочевины;
синтеза креатина, холина.
Мышцы составляют у взрослого человека 40 % от массы тела.
Функция мышц — напряжение и укорочение с последующим расслаблением.
Значение мышц — обеспечение подвижности организма и сопротивление механической силе, в том числе и статические нагрузки.
Механизм работы мышц — превращение химической энергии в механическую.
К мышечной ткани относятся:
▪скелетная мускулатура;
▪сердечная мышца;
▪гладкая мускулатура.
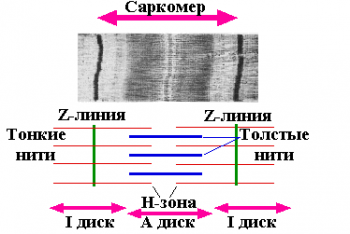
Скелетная и сердечная мышцы под микроскопом имеют поперечно-полосатое строение, а гладкая — нет. Мышечные клетки состоят из миофибрилл, а функциональной единицей миофибрилл является саркомер.
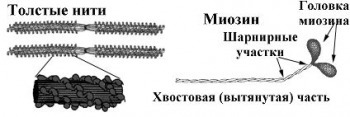
1. Миозин — основа толстых нитей. Молекулярная масса ≈ 500.000 Да. Молекула миозина имеет вытянутую часть, состоящую из двух спиралей, накрученных одна на другую. Каждая спираль имеет на одном конце глобулярную головку и называется тяжёлой цепью. Возле головок спиралей располагается по 2 лёгких цепи.
При обработке ферментами молекула миозина распадается на 2 больших фрагмента: тяжёлый меромиозин (обе головки и часть двойной спирали) и лёгкий меромиозин (остальная часть двойной спирали).
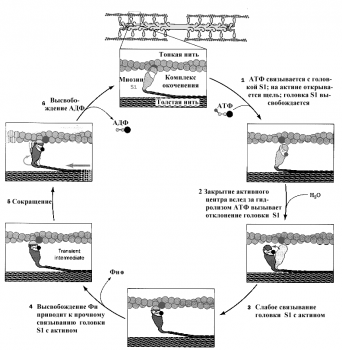
В ответ на нервный импульс происходит выброс ионов кальция из саркоплазматического ретикулума (СПР). Эти ионы связываются с лёгкими цепями миозина, при этом в головке расщепляется АТФ и головка готова присоединиться к актину. Ионы кальция затем связываются с тропонином С и меняют его конформацию. Эти изменения в силу эффекта кооперации передаются на субъединицу I и блокируют её. Далее изменения достигают субъединицы Т, которая и сдвигает в сторону молекулу тропомиозина, освобождая сразу 7 молекул актина. Головка миозина соединяется с актином, и образуется «поперечный мостик». Как только это произошло, АДФ и Фн уходят, головка наклоняется в сторону М-линии и тянет за собой тонкую нить. Затем к головке миозина присоединяется новая молекула АТФ, головка отделяется от нити актина, а гидролиз АТФ возвращает головку в вертикальное положение. Далее всё повторяется. Информацией о конце сокращения служит снижение концентрации ионов кальция в СПР. Тогда кальциевый насос и белок кальсеквестрин убирают избыток ионов кальция из цитоплазмы в СПР. Мышца переходит в состояние покоя.
1.Основной регулятор энергетики мышечной клетки — это отношение [АТФ]/ [АДФ]∙[Фн]. В покое концентрация АТФ высокая, а АДФ — низкая, в результате чего тормозится активность ключевых ферментов гликолиза, цикла Кребса и работа дыхательной цепи. С началом работы мышц концентрация АТФ падает, а АДФ возрастает, что приводит к активации вышеназванных процессов.
2.Накапливающийся при работе мышц лактат поступает из крови в печень, где путём глюконеогенеза превращается в глюкозу, которая поступает сначала в кровь, а затем в мышцы, где восстанавливает запас гликогена.
3.Аденилаткиназная (миокиназная) реакция:
2 АДФ ↔ АТФ + АМФ.
АТФ используется для мышечного сокращения, а АМФ стимулирует гликолиз.
4.Креатинкиназная реакция:
Креатин + АТФ↔КФ + АДФ.
Покоящиеся мышцы содержат в 10–20 раз больше КФ, чем АТФ, но КФ, в отличие от АТФ, не может использоваться мышцами для сокращения. Роль КФ заключается в том, что он является не только транспортной формой энергии в мышцах, но и отдаёт свою богатую энергией связь АДФ для образования АТФ, который и расходуется при сокращении. Это система быстрого реагирования: она включается первой при нехватке АТФ в мышцах. Запаса КФ хватает только на 10 с, но за это время запускаются 1–3-й механизмы. Особенно эта система важна для миокарда, так как он очень чувствителен к недостатку кислорода и имеет исключительно аэробный характер обмена в отличие от скелетной мускулатуры.
2.Накапливающийся при работе мышц лактат поступает из крови в печень, где путём глюконеогенеза превращается в глюкозу, которая поступает сначала в кровь, а затем в мышцы, где восстанавливает запас гликогена.
3.Аденилаткиназная (миокиназная) реакция:
2 АДФ ↔ АТФ + АМФ.
АТФ используется для мышечного сокращения, а АМФ стимулирует гликолиз.
4.Креатинкиназная реакция:
Креатин + АТФ↔КФ + АДФ.
Покоящиеся мышцы содержат в 10–20 раз больше КФ, чем АТФ, но КФ, в отличие от АТФ, не может использоваться мышцами для сокращения. Роль КФ заключается в том, что он является не только транспортной формой энергии в мышцах, но и отдаёт свою богатую энергией связь АДФ для образования АТФ, который и расходуется при сокращении. Это система быстрого реагирования: она включается первой при нехватке АТФ в мышцах. Запаса КФ хватает только на 10 с, но за это время запускаются 1–3-й механизмы. Особенно эта система важна для миокарда, так как он очень чувствителен к недостатку кислорода и имеет исключительно аэробный характер обмена в отличие от скелетной мускулатуры.
Распад большинства аминокислот начинается с переаминирования. Эти реакции не высвобождают аммиак, а переносят аминогруппу с аминокислоты на кетокислотный акцептор. Трансаминазы используют пиридоксальфосфат в качестве коэнзима. Это главный путь удаления азота у аминокислот. Существуют трансаминазы для большинства аминокислот. После поступления пищевых аминокислот из воротной вены печень трансаминирует значительную часть аминокислот. Исключением являются аминокислоты с разветвленным углеводородным радикалом, для них в печени нет соответствующей трансаминазы. Концентрация таких аминокислот в крови, оттекающей от печени, выше, чем в системе воротной вены.
Стратегия реакции переаминирования — перенос аминогруппы от различных групп донорных аминокислот на ограниченное число -кетокислотных акцепторов, что позволяет выделить центральный путь метаболизма аминокислот. Большинство трансаминаз использует -кетоглутаровую кислоту как основной акцептор аминогруппы. Трансаминазы обычно называют по аминокислотам, которые служат донором аминогруппы.
Субстратная специфичность трансаминаз. Каждая трансаминаза специфична для одного или нескольких аминокислотных доноров.
Стратегия реакции переаминирования — перенос аминогруппы от различных групп донорных аминокислот на ограниченное число -кетокислотных акцепторов, что позволяет выделить центральный путь метаболизма аминокислот. Большинство трансаминаз использует -кетоглутаровую кислоту как основной акцептор аминогруппы. Трансаминазы обычно называют по аминокислотам, которые служат донором аминогруппы.
Субстратная специфичность трансаминаз. Каждая трансаминаза специфична для одного или нескольких аминокислотных доноров.
-Глутамильный цикл. Главную роль в этой транспортной системе играет мембраносвязанный фермент -глутамилтрансфераза. Фермент катализирует перенос - глутамильной группы от глутатиона на транспортируемую аминокислоту. Затем комплекс - глутамиламинокислота поступает в клетку. Далее с помощью еще пяти внутриклеточных ферментов происходит освобождение из дипептида свободной аминокислоты и ресинтез затраченной на транспорт молекулы глутатиона.
Компоненты желудочного сока:
1)НCl — секретируется обкладочными клетками вместе с электролитами;
2)гастрин — полипептидный гормон, секретируемый слизистыми клетками желудка;
3)пепсиноген — неактивный предшественник пепсина, секретируется главными клетками желудка.
Функции желудочного сока:
1)Гастрин секретируется в ответ на поступление химуса в желудок; два места приложения действия гастрина:
обкладочные клетки: стимулирует секрецию НСl;
главные клетки: стимулирует секрецию пепсиногена.
2)НСl снижает рН химуса, поступающего в желудок; денатурирует пищевые белки, создает оптимальный рН для действия пепсина и инициирует ограниченный протеолиз пепсиногена.
1)НCl — секретируется обкладочными клетками вместе с электролитами;
2)гастрин — полипептидный гормон, секретируемый слизистыми клетками желудка;
3)пепсиноген — неактивный предшественник пепсина, секретируется главными клетками желудка.
Функции желудочного сока:
1)Гастрин секретируется в ответ на поступление химуса в желудок; два места приложения действия гастрина:
обкладочные клетки: стимулирует секрецию НСl;
главные клетки: стимулирует секрецию пепсиногена.
2)НСl снижает рН химуса, поступающего в желудок; денатурирует пищевые белки, создает оптимальный рН для действия пепсина и инициирует ограниченный протеолиз пепсиногена.
Протеолитические ферменты вовлекаются в большое число разнообразных физиологических процессов. Протеолиз может протекать вне клеток и внутриклеточно. Действие протеолитических ферментов может быть разделено на две различные категории:
1)ограниченный протеолиз, в котором протеаза специфически расщепляет одну или несколько пептидных связей в белке-мишени, что обычно приводит к изменению функционального состояния последнего: ферменты, например, при этом становятся активными, а прогормоны превращаются в гормоны;
2)неограниченный или тотальный протеолиз, при котором белки распадаются до своих аминокислот.
Протеазы классифицируются по типу их механизма катализа. Международный союз по биохимии и молекулярной биологии выделяет четыре класса протеаз:
Сериновые протеиназы
Аспарагиновые протеиназы
Цистеиновые протеиназы
Металлопротеиназы
1)ограниченный протеолиз, в котором протеаза специфически расщепляет одну или несколько пептидных связей в белке-мишени, что обычно приводит к изменению функционального состояния последнего: ферменты, например, при этом становятся активными, а прогормоны превращаются в гормоны;
2)неограниченный или тотальный протеолиз, при котором белки распадаются до своих аминокислот.
Протеазы классифицируются по типу их механизма катализа. Международный союз по биохимии и молекулярной биологии выделяет четыре класса протеаз:
Сериновые протеиназы
Аспарагиновые протеиназы
Цистеиновые протеиназы
Металлопротеиназы
Азотистый баланс — общий показатель обмена белка в организме. Азотистый баланс — это разница между поступлением азота (обычно в форме белка) и его выведением (обычно в форме неусвоенного белка из кишечника и мочевины — почками). Положительный азотистый баланс наблюдается при задержке азота в организме, что отмечается при росте, беременности или в послеоперационном периоде. Отрицательный азотистый баланс отражает общую потерю белков, нередко связанную с неполноценным белковым питанием. У здорового взрослого человека отмечается азотистое равновесие, при котором потери азота компенсируются поступлением белков с пищей.
Норма белка в питании — 80–100 г.
Биологическая ценность белков определяется наличием и соотношением незаменимых аминокислот: вал, лей, илей, тре, мет, фен, три, лиз (для детей еще арг и гис).
Норма белка в питании — 80–100 г.
Биологическая ценность белков определяется наличием и соотношением незаменимых аминокислот: вал, лей, илей, тре, мет, фен, три, лиз (для детей еще арг и гис).