Антикоагулянтная система — это ряд ингибиторов свёртывания (антикоагулянтов), осуществляющих контроль скорости активирования факторов свёртывания и реакций между ними.
Практически каждому из участников процесса фибринообразования противостоят специфические ингибиторы. Многие антикоагулянты обладают антитромбиновым действием.
По механизму образования в организме все естественные (физиологические) антикоагулянты разделяют на первичные и вторичные. Первичные антикоагулянты постоянно синтезируются и с постоянной скоростью выделяются в кровоток. Первичные антикоагулянты ингибируют активные факторы коагуляции и не действуют на неактивные формы этих факторов. Вторичные антикоагулянты образуются из факторов свёртывания и других белков в процессе свёртывания крови, фибринолиза и активации других протеолитических систем.
Из физиологических антикоагулянтов функционально наиболее значимыми являются антитромбин III, гепарин, протеины С и S, 2-макроглобулин, липопротеин-ассоциированный коагуляционный ингибитор (ЛАКИ).
Практически каждому из участников процесса фибринообразования противостоят специфические ингибиторы. Многие антикоагулянты обладают антитромбиновым действием.
По механизму образования в организме все естественные (физиологические) антикоагулянты разделяют на первичные и вторичные. Первичные антикоагулянты постоянно синтезируются и с постоянной скоростью выделяются в кровоток. Первичные антикоагулянты ингибируют активные факторы коагуляции и не действуют на неактивные формы этих факторов. Вторичные антикоагулянты образуются из факторов свёртывания и других белков в процессе свёртывания крови, фибринолиза и активации других протеолитических систем.
Из физиологических антикоагулянтов функционально наиболее значимыми являются антитромбин III, гепарин, протеины С и S, 2-макроглобулин, липопротеин-ассоциированный коагуляционный ингибитор (ЛАКИ).
Назначение свёртывающей системы крови — образование нерастворимого фибрина. В свёртывающую систему крови входят ферментные и неферментные белки плазмы, тканей и форменных элементов крови (прежде всего тромбоцитов), надмолекулярные образования (фрагменты клеточных мембран) и ионизированный кальций. Международный комитет по выработке номенклатуры факторов свёртывания присвоил арабскую нумерацию тромбоцитарным (P1–11) и римскую (ф.I–XIII) — плазменным и тканевым факторам.
Большинство плазменных факторов гемокоагуляции являются ферментами (сериновые протеиназы), синтезируются в печени и секретируются в кровь в неактивном состоянии, то есть в виде прокоагулянтов. Активирование большинства прокоагулянтов осуществляется путём частичного протеолиза. На определённых этапах процесс свёртывания резко ускоряется неферментными белками (ф.VIII и ф.V), выполняющими роль коферментов.
Свёртывание крови (гемокоагуляция) — цепной каскадный ферментативный процесс, в ходе которого происходит взаимодействие и последовательная активация ряда сериновых протеиназ на фосфолипидных матрицах (тромбопластинах), заканчивающийся превращением растворимого фибриногена в нерастворимый фибрин.
Большинство плазменных факторов гемокоагуляции являются ферментами (сериновые протеиназы), синтезируются в печени и секретируются в кровь в неактивном состоянии, то есть в виде прокоагулянтов. Активирование большинства прокоагулянтов осуществляется путём частичного протеолиза. На определённых этапах процесс свёртывания резко ускоряется неферментными белками (ф.VIII и ф.V), выполняющими роль коферментов.
Свёртывание крови (гемокоагуляция) — цепной каскадный ферментативный процесс, в ходе которого происходит взаимодействие и последовательная активация ряда сериновых протеиназ на фосфолипидных матрицах (тромбопластинах), заканчивающийся превращением растворимого фибриногена в нерастворимый фибрин.
Система свёртывания крови по функциональному признаку делится на две системы: свёртывающую (гемокоагуляционную) и противосвёртывающую (антитромботическую). Противосвёртывающее действие обеспечивается антикоагулянтной и фибринолитической системами. Поддержание жидкого состояния циркулирующей крови обеспечивается взаимодействием свёртывающей и противосвёртывающей систем крови, которые в физиологических условиях находятся в динамическом равновесии.
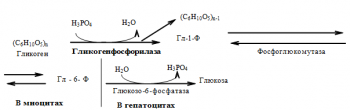
Схема фосфоролиза гликогена
Распад гликогена в мышцах происходит при мышечных сокращениях, а в печени — при голодании и в перерывах между приёмами пищи. Основной механизм гликогенолиза — фосфоролиз (расщепление -1,4-гликозидных связей с участием фосфорной кислоты и гликогенфосфорилазы).
Различия гликогенолиза в печени и мышцах. В гепатоцитах есть фермент глюкозо-6- фосфатаза и образуется свободная глюкоза, которая поступает в кровь. В миоцитах нет глюкозо-6-фосфатазы. Образовавшийся глюкозо-6-фосфат не может выйти из клетки в кровь (фосфорилированная глюкоза не проходит цитоплазматическую мембрану) и используется на нужды миоцитов.
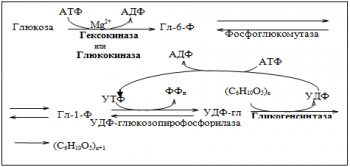
Схема синтеза гликогена
Общее содержание гликогена в организме взрослого человека около 450 г (в печени —
до 150 г, в мышцах — около 300 г). Более интенсивно гликогенез осуществляется в печени.
Гликогенсинтаза — ключевой фермент процесса — катализирует присоединение глюкозы к молекуле гликогена с образованием -1,4-гликозидных связей.
Существует группа белков-переносчиков глюкозы (ГЛЮТ), сходных по структуре, но различающихся по участию в транспорте глюкозы (пять изоформ собственных транспортеров глюкозы). Они локализованы в плазматических мембранах всех клеток и участвуют в транспорте глюкозы (ускоряют транспорт) по градиенту её концентрации.
Инсулин стимулирует поступление глюкозы в адипоциты, миоциты и кардиомиоциты, увеличивая количество ГЛЮТ 4 в плазматических мембранах этих клеток.
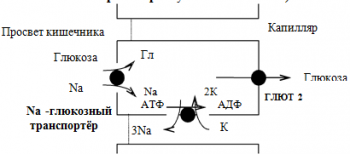
Всасывание глюкозы происходит в два этапа. I этап — транспорт глюкозы из полости тонкого кишечника в энтероциты. Осуществляется по двум механизмам:
натрий-независимый транспорт с участием ГЛЮТ 5;
натрий-зависимый транспорт с участием Na -глюкозного транспортёра.
2 этап — транспорт глюкозы из энтероцитов в капилляры портальной венозной системы (натрий-независимый транспорт с участием ГЛЮТ 2).
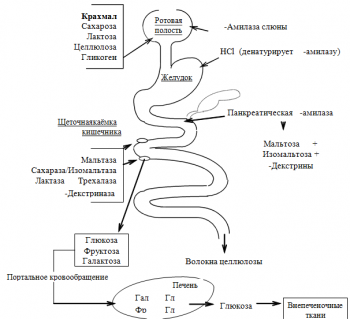
Ротовая полость. -Амилаза слюны гидролизует внутренние -1,4-гликозидные связи. Продуктами пищеварения являются олигосахаридные фрагменты (декстрины), в небольшом количестве — мальтоза и глюкоза.
Тонкий кишечник. Секретин стимулирует выделение панкреатического сока.
Холецистокинин-панкреозимин стимулирует секрецию панкреатической - амилазы и других панкреатических ферментов пищеварения.
Панкреатическая - амилаза гидролизует внутренние - 1,4-гликозидные связи олигосахаридов и полисахаридов до мальтозы, изомальтозы и - декстринов.
Углеводы — альдегиды и кетоны многоатомных спиртов, а также производные и полимеры этих соединений.
Углеводы пищи. Большая часть углеводов поступает в организм с пищей растительного происхождения. Обычный суточный рацион содержит 400–500 г углеводов, из которых 60–80 % составляют полисахариды (в основном крахмал, в меньшем количестве — гликоген и пищевые волокна), 20–30 % олигосахариды (сахароза, лактоза, мальтоза), остальное количество — моносахариды (в основном глюкоза, фруктоза и пентозы). Углеводы обеспечивают 60–70 % (не менее 50 %) суточного энергопотребления. В кишечнике всасываются моносахариды, поэтому в процессе переваривания углеводов пищи должно происходить их расщепление до моносахаридов.
Углеводы пищи. Большая часть углеводов поступает в организм с пищей растительного происхождения. Обычный суточный рацион содержит 400–500 г углеводов, из которых 60–80 % составляют полисахариды (в основном крахмал, в меньшем количестве — гликоген и пищевые волокна), 20–30 % олигосахариды (сахароза, лактоза, мальтоза), остальное количество — моносахариды (в основном глюкоза, фруктоза и пентозы). Углеводы обеспечивают 60–70 % (не менее 50 %) суточного энергопотребления. В кишечнике всасываются моносахариды, поэтому в процессе переваривания углеводов пищи должно происходить их расщепление до моносахаридов.
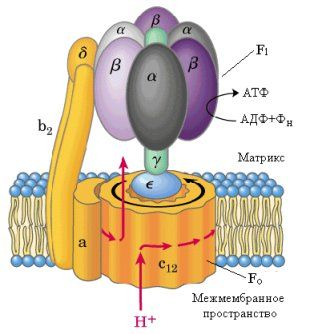
Ι. НАДН-убихинон-оксидоредуктаза. Принимает электроны и протоны от НАДН•Н+;
протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.
Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью.
Ι. НАДН-убихинон-оксидоредуктаза. Принимает электроны и протоны от НАДН•Н+;
протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.
Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью.
протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.
Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью.
Ι. НАДН-убихинон-оксидоредуктаза. Принимает электроны и протоны от НАДН•Н+;
протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.

Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью.
Большая часть кислорода, потребляемого клеткой (около 80 %), используется, как указано, в митохондриях с участием цитохромоксидазы. Это так называемый оксидазный путь. При этом происходит полное восстановление кислорода, причем субстрат не реагирует с кислородом непосредственно. Данный путь дает клетке энергию в виде АТФ. Помимо цитохромоксидазы существуют другие оксидазы (ФМН и ФАД-зависимые), которые катализируют реакции окисления веществ с образованием перекиси водорода.
Наряду с этим существует другой путь окисления – оксигеназный. Он не дает клетке энергии, кислород включается в субстрат с образованием новой гидроксильной или карбоксильной группы. Этот путь происходит в основном в мембранах эндоплазматического ретикулума (микросомах). Путем микросомного окисления осуществляется α- и ω- окисление жирных кислот, синтез ненасыщенных жирных кислот, стероидов. Таким путем обезвреживаются ксенобиотики, т. е. чужеродные для организма вещества (лекарства, ядохимикаты, косметические препараты). Ферменты, осуществляющие такое окисление, называются оксигеназами. Различают диоксигеназы, которые включают в молекулу субстрата два атома молекулы кислорода. Более распространены в клетках монооксигеназы (гидроксилазы). Они катализируют реакции, при которых в молекулу субстрата включается один атом из молекулы кислорода, второй же атом кислорода восстанавливается при этом до воды. Монооксигеназные системы представляют собой короткие цепи переноса электронов и протонов, источником которых служит чаще всего восстановленный НАДФ+, реже НАД+ или аскорбиновая кислота. Активатором кислорода при этом является цитохром Р450 – одноцепочечный хромопротеин с молекулярной массой 50 кДа.
Наряду с этим существует другой путь окисления – оксигеназный. Он не дает клетке энергии, кислород включается в субстрат с образованием новой гидроксильной или карбоксильной группы. Этот путь происходит в основном в мембранах эндоплазматического ретикулума (микросомах). Путем микросомного окисления осуществляется α- и ω- окисление жирных кислот, синтез ненасыщенных жирных кислот, стероидов. Таким путем обезвреживаются ксенобиотики, т. е. чужеродные для организма вещества (лекарства, ядохимикаты, косметические препараты). Ферменты, осуществляющие такое окисление, называются оксигеназами. Различают диоксигеназы, которые включают в молекулу субстрата два атома молекулы кислорода. Более распространены в клетках монооксигеназы (гидроксилазы). Они катализируют реакции, при которых в молекулу субстрата включается один атом из молекулы кислорода, второй же атом кислорода восстанавливается при этом до воды. Монооксигеназные системы представляют собой короткие цепи переноса электронов и протонов, источником которых служит чаще всего восстановленный НАДФ+, реже НАД+ или аскорбиновая кислота. Активатором кислорода при этом является цитохром Р450 – одноцепочечный хромопротеин с молекулярной массой 50 кДа.
Первый фермент цитратсинтаза ингибируется АТФ, жирными кислотами. Лимитирующим ферментом (катализирует самую медленную реакцию) является изоцитратДГ. Он активируется АДФ, НАД+, ингибируется АТФ, восстановленной формой НАДН•Н+. Когда в клетке достаточно АТФ (покой), скорость цикла снижается, при распаде же АТФ образуется АДФ, который активирует самую медленную реакцию и, следовательно, скорость всего цикла в целом.
Познакомившись с центральными путями метаболизма, основное назначение которых — отделение от субстратов атомов водорода, проследим за судьбой этих атомов, за тем, как происходит их окисление кислородом до воды.
Познакомившись с центральными путями метаболизма, основное назначение которых — отделение от субстратов атомов водорода, проследим за судьбой этих атомов, за тем, как происходит их окисление кислородом до воды.