 ■ радиомодификацияпутем защиты нормальных тканей от лучевого воздействия (не применяется).
■ радиомодификацияпутем защиты нормальных тканей от лучевого воздействия (не применяется). • радиопротекторы мексамин и цистамин (препараты военных, не применяются).
• гипоксирадиотерапия - вдыхание газовых гипоксических смесей, содержащих 8 или 10% О2 в смеси с закисью азота. Позволяет увеличить дозу облучения.
■ радиомодифицирование путем усиления лучевого поражения опухолей
• оксигенорадиотерапия - больной во время облучения находится в барокамере. Повышается оксигенация опухолевых клеток, они становятся более восприимчивыми к облучению.
Типы опухолевых гипоксий:
• хроническая
• острая
• гипоксия, индуцируемая анемией.
■ химическая радиосенсибилизация. Суть - механизм канцерицидного действия лучевой терапии. Перенос электронок на клетку → высвобождение второго электрона → ионизация → прямое дей-ствие на ДНК. Непрямое действие - через радиолиз воды.
Основана на использовании свойства опухолевых тканей накапливать фотосенсибилизаторы в зна-чительно большей степени, чем окружающие здоровые ткани. При облучении светом в видимом диапазоне (400-700 нм), спектральный состав которого соответствует спектру поглощения фотосен-сибилизатора, в клетках опухоли происходит фотохимическая реакция с образованием цитотоксиче-ских агентов, вызывающих их гибель.
Фотодинамическая терапия
■ Межклеточное пространство
• Иммунный механизм
• Активация антиметастатической потенции
■ Опухолевые клетки→ прямое цитотоксическое действие:
• Эндоплазматическая мембрана
• Митохондрии
• Ядро
• Лизосомы
■ Сосуды
• Противососудистое и анангиогенное
Фотодинамическая терапия
■ Межклеточное пространство
• Иммунный механизм
• Активация антиметастатической потенции
■ Опухолевые клетки→ прямое цитотоксическое действие:
• Эндоплазматическая мембрана
• Митохондрии
• Ядро
• Лизосомы
■ Сосуды
• Противососудистое и анангиогенное
 Абластика - принципы оперирования, препятствующие отторжению и миграции опухолевых кле-ток и их комплексов по сосудам и/или оставление их в ране.
Абластика - принципы оперирования, препятствующие отторжению и миграции опухолевых кле-ток и их комплексов по сосудам и/или оставление их в ране.■ принцип анатомической зональности - удаление опухоли в пределах заведомо здоровых тканей единым блоком с окружающими тканями и регионарными лимфаузлами
■ принцип футлярности - опухоль удаляют в целостном "футляре из здоровых тканей"
■ для уменьшения гематогенной диссеминации перевязку начинают с магистральных сосудов, вна-чале вен, затем артерий; для рассечения используется электрокоагулирующий скальпель.
■ для профилактики обсеменения опухолевых клеток используются:
• прошивание лимфатических магистралей механическими швами
• частая смена марлевых салфеток, тупферов, инструментов
• ограничение операционного поля
■ для предотвращения диссеминации опухолевых клеток по просвету полых органов последние перевязываются проксимальнее и дистальнее опухоли.
Правильнее его называть "раком бронха".
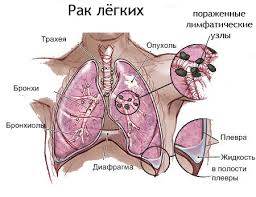 Эпидемиология
Эпидемиология
Рак легкого занимает 1 место в мире среди онкологических заболеваний, и 2 место в РБ (после рака кожи). Чаще болеют мужчины (10:1). Обычно он возникает в пожилом возрасте. Ежегодно умирает более 2 млн человек.
Этиология
В развитии рака легкого имеют значение:
■ Курение. Смолы из табака (80% больных раком легкого – курильщики). Смолы вызывают ХОБЛ, снижается защитная реакция слизистой бронхов, цилиндрический эпителий замещается на пло-скоклеточный (метаплазия)
■ Канцерогены:
• 222Rn - бесцветный инертный газ, возникающий при распаде урана-238 (содержится в граните), в подвалах.
• Асбест - промышленный изоляционный материал. Вызывает гиперплазию и дисплазию клеток бронхиального эпителия и способен вызывать мутации в геноме клеток слизистой оболочки трахеи.
• Ионизирующее излучение
■ Заболевания легких
• Туберкулез (деструктивные формы)
• бронхит,
• бронхоэктазы,
• пневмокониозы.
 Эпидемиология
ЭпидемиологияРак легкого занимает 1 место в мире среди онкологических заболеваний, и 2 место в РБ (после рака кожи). Чаще болеют мужчины (10:1). Обычно он возникает в пожилом возрасте. Ежегодно умирает более 2 млн человек.
Этиология
В развитии рака легкого имеют значение:
■ Курение. Смолы из табака (80% больных раком легкого – курильщики). Смолы вызывают ХОБЛ, снижается защитная реакция слизистой бронхов, цилиндрический эпителий замещается на пло-скоклеточный (метаплазия)
■ Канцерогены:
• 222Rn - бесцветный инертный газ, возникающий при распаде урана-238 (содержится в граните), в подвалах.
• Асбест - промышленный изоляционный материал. Вызывает гиперплазию и дисплазию клеток бронхиального эпителия и способен вызывать мутации в геноме клеток слизистой оболочки трахеи.
• Ионизирующее излучение
■ Заболевания легких
• Туберкулез (деструктивные формы)
• бронхит,
• бронхоэктазы,
• пневмокониозы.
■ выбор рационального доступа к пораженному органу осуществляется с учетом локализации и то-пографо-анатомических особенностей зоны опухоли, ее размеров, распространенности и функци-онального состояния пациента.
■ техника оперирования - атравматичная
■ орган или ткани, пораженные опухолью, для достижения радикальности иссекаются с учетом распространенности, характера роста опухоли и особенностей метастазирования
• экзофитный рост - линия резекции на 2 см от видимого края опухоли
• эндофитный рост - не менее 6 см!!!
■ радикальным при злокачественной опухоли считается тотальное или субтотальное удаление ор-гана в едином блоке с клетчаткой, содержащей регионарные лимфаузлы в пределах их фасциаль-ного футляра.
■ после операции хирург описывает макропрепарат, отмечает границы резекции, маркирует лим-фаузлы и отправляет материал в лабораторию для морфологического исследования
■ техника оперирования - атравматичная
■ орган или ткани, пораженные опухолью, для достижения радикальности иссекаются с учетом распространенности, характера роста опухоли и особенностей метастазирования
• экзофитный рост - линия резекции на 2 см от видимого края опухоли
• эндофитный рост - не менее 6 см!!!
■ радикальным при злокачественной опухоли считается тотальное или субтотальное удаление ор-гана в едином блоке с клетчаткой, содержащей регионарные лимфаузлы в пределах их фасциаль-ного футляра.
■ после операции хирург описывает макропрепарат, отмечает границы резекции, маркирует лим-фаузлы и отправляет материал в лабораторию для морфологического исследования
В зависимости от распространенности опухолевого процесса и характера операции выделяют следующие виды оперативных вмешательств:
■ радикальные - удаление опухоли и/или всех видимых опухолевых очагов вместе с пораженным органом.
• типовые (стандартные) - удаление пораженного опухолью органа или его части одним бло-ком вместе с регионарным лимфатическим аппаратом
• комбинированные - удаление как пораженного опухолью органа, так и соседних органов, на которые распространилась опухоль
• расширенные - в блок удаляемых тканей вынужденно включаются дополнительные группы лимфаузлов
• экономные
• органосохраняющие - на конечностях, молочной железе.
■ Паллиативные - удаление первичной опухоли в объеме радикального вмешательства при нали-чии отдаленных или неудалимых регионарных метастазов с целью продления жизни больного и улучшения ее качества.
■ Циторедуктивные - операции при диссеминированных опухолях, чувствительных к лучевым и/или лекарственным методам лечения. "Кусковое" удаление опухоли, на оставшуюся часть опу-холи - химиотерапия
■ Повторные (second-look) - полное удаление остаточной опухоли после химиотерапии, когда во время первой операции опухоль была неоперабельной или удалена частично.
■ радикальные - удаление опухоли и/или всех видимых опухолевых очагов вместе с пораженным органом.
• типовые (стандартные) - удаление пораженного опухолью органа или его части одним бло-ком вместе с регионарным лимфатическим аппаратом
• комбинированные - удаление как пораженного опухолью органа, так и соседних органов, на которые распространилась опухоль
• расширенные - в блок удаляемых тканей вынужденно включаются дополнительные группы лимфаузлов
• экономные
• органосохраняющие - на конечностях, молочной железе.
■ Паллиативные - удаление первичной опухоли в объеме радикального вмешательства при нали-чии отдаленных или неудалимых регионарных метастазов с целью продления жизни больного и улучшения ее качества.
■ Циторедуктивные - операции при диссеминированных опухолях, чувствительных к лучевым и/или лекарственным методам лечения. "Кусковое" удаление опухоли, на оставшуюся часть опу-холи - химиотерапия
■ Повторные (second-look) - полное удаление остаточной опухоли после химиотерапии, когда во время первой операции опухоль была неоперабельной или удалена частично.
Методы лечения:
■ хирургический
■ лекарственный
• химиотерапия
• гормонотерапия
• биотерапия (иммунотерапия)
■ лучевой
■ сопроводительная терапия
Планирование лечения и наблюдения за больными злокачественными новообразованиями:
■ хирургическая + лекарственная + лучевая терапия + патогистологическая лаборатория
■ консилиум - хирург + радиолог + химиотерапевт + патолог
■ составление плана лечения
■ исполнение плана лечения с полной индивидуальной ответственностью каждого участника кон-силиума. При необходимости - коррекция плана лечения.
■ ответственность консилиума за оказание помощи больному с момента первой консультации, в течение всего курса лечения и при последующем наблюдении.
■ хирургический
■ лекарственный
• химиотерапия
• гормонотерапия
• биотерапия (иммунотерапия)
■ лучевой
■ сопроводительная терапия
Планирование лечения и наблюдения за больными злокачественными новообразованиями:
■ хирургическая + лекарственная + лучевая терапия + патогистологическая лаборатория
■ консилиум - хирург + радиолог + химиотерапевт + патолог
■ составление плана лечения
■ исполнение плана лечения с полной индивидуальной ответственностью каждого участника кон-силиума. При необходимости - коррекция плана лечения.
■ ответственность консилиума за оказание помощи больному с момента первой консультации, в течение всего курса лечения и при последующем наблюдении.
■ Физические
• Ионизирующее излучение
• Ультрафиолетовое излучение
• Инфракрасное излучение
• Неионизирующее электромагнитное излучение
• Механическая травма тканей
■ Химические
• ПАУ
• Бензол и его гомологи
• Нитрозосоединения
• Металлы, асбест
• Природные канцерогены
• Лекарственные препараты
• Полимерные материалы
• Эндогенные канцерогены
• Курение, питание, алкоголь
• Профессиональные факторы
• Канцерогенные жилища
■ Биологические
• Вирусные
• Паразитарные
• H. Pylori
Химические канцерогены:
■ Антропогенные
■ Природные
По механизму реализации своего канцерогенного действия химические канцерогены делятся на:
■ Генотоксические – вызывают мутации при прямом взаимодействии канцерогена или его метаболитов с ДНК (оставляют след в геноме клетки в виде активации онкогена).
■ Негенотоксические – в результате спонтанной мутации или вторичных влияний на ДНК (оксидантный стресс, торможение апоптоза), т.е. негеномных воздействий. В геноме будут воздействия, соответствующие римененным негенотоксикантам.
Формирование злокачественной опухоли – не одноразовое событие, а цепь последовательных взаимосвязанных событий, каждое из которых обусловлено воздействием определенных факторов, как внешних, так и внутренних. В ходе этих событий имеет место последовательное накопление повреждений генома клеток, что приводит к качественным сдвигам в их структуре и функции, и, в конечном счете, к нарушениям дифференцировки и обретению присущих опухоли свойств.
В настоящее время в канцерогенезе различают три стадии, зачастую накладывающихся друг на друга. Первая, необратимая, стадия называется инициацией, а вызывающие ее канцерогены – инициаторами. Вторую, обратимую, стадию назвали промоцией, а соответствующие агенты – промоторами. Третью стадию – формирования злокачественной опухоли со всеми присущими ей свойствами – прогрессией. В течение каждой из стадий действуют определенные этиологические факторы, каждая из них отличается специфическими морфологическими проявлениями и характеризуется особыми изменениями в геноме.
Инициация (или опухолевая трансформация) – это первый шаг, сущность которого составляет быстрое (минуты, часы), необратимое и нелетальное изменение генома соматических клеток в виде мутаций. При этом происходит активация онкогенов или подавление антионкогенов и соответственно увеличенное воспроизводство белков онкогенов и утрата белков регуляторных генов (антионкогенов). Однако трансформированные таким образом клетки остаются неактивными без дополнительного стимула к пролиферации. Считается, что дальнейший процесс канцерогенеза на этом этапе может оборваться.
В настоящее время в канцерогенезе различают три стадии, зачастую накладывающихся друг на друга. Первая, необратимая, стадия называется инициацией, а вызывающие ее канцерогены – инициаторами. Вторую, обратимую, стадию назвали промоцией, а соответствующие агенты – промоторами. Третью стадию – формирования злокачественной опухоли со всеми присущими ей свойствами – прогрессией. В течение каждой из стадий действуют определенные этиологические факторы, каждая из них отличается специфическими морфологическими проявлениями и характеризуется особыми изменениями в геноме.
Инициация (или опухолевая трансформация) – это первый шаг, сущность которого составляет быстрое (минуты, часы), необратимое и нелетальное изменение генома соматических клеток в виде мутаций. При этом происходит активация онкогенов или подавление антионкогенов и соответственно увеличенное воспроизводство белков онкогенов и утрата белков регуляторных генов (антионкогенов). Однако трансформированные таким образом клетки остаются неактивными без дополнительного стимула к пролиферации. Считается, что дальнейший процесс канцерогенеза на этом этапе может оборваться.
В настоящее принята онкогенно-антионкогенная мутационная теория рака.
Основные ее положения:
■ Рак развивается вследствие мутации протоонкогенов, антионкогена. Мутации в протоонкогенах приводят к их активации, и они называются онкогенами. Протоонкогенов в норме около 120, и в норме они есть в генотипе всех людей, животных, организмов, и стимулируют процессы проли-ферации и дифференцировки клеток. Поэтому при активации протоонкогена резко усиливается пролиферация клеток, необходимая для «закрепления» мутаций в клетках. Если мутировавшая клетка не будет делиться, то она не представляет угрозы, и не будет трансформироваться в опу-холь. Мутации в антионкогенах (их около 20) приводят к их инактивации. В норме они угнетают процессы пролиферации и усиливают апоптоз. Мутации в остальных генах человека к раку не приведут.
■ Для развития рака необходимо от 3 до 7 мутаций, в среднем 4 мутации в 3-4-х генах. Одна мута-ция к развитию рака не приведет.
■ Необходимым условием для возникновения раковой клетки является пролиферация мутировав-ших клеток, потому что эта мутация должна передаться по наследству.
■ Мутации могут быть в соматических клетках, могут изначально быть и в половых клетках. Пере-даются по наследству антионкогены. Плод выживает, растет, развивается. При мутации в онко-генах плод не развивается. Если ребенку передается наследственная мутация в антионкогене, то эта мутация будет во всех соматических клетках. Это предрасположенность к раку, но не рак. Но ребенок рождается уже с одной мутацией, и накопить критическое число мутаций ему нужно го-раздо меньше времени. Поэтому универсальное свойство наследственно-предрасположенных ра-ков – это молодой возраст заболевших. Рак молодых может быть еще при очень большой канце-рогенной нагрузке. Таким образом, рак – это генетическая болезнь. Следовательно, рак не заразен.
Основные ее положения:
■ Рак развивается вследствие мутации протоонкогенов, антионкогена. Мутации в протоонкогенах приводят к их активации, и они называются онкогенами. Протоонкогенов в норме около 120, и в норме они есть в генотипе всех людей, животных, организмов, и стимулируют процессы проли-ферации и дифференцировки клеток. Поэтому при активации протоонкогена резко усиливается пролиферация клеток, необходимая для «закрепления» мутаций в клетках. Если мутировавшая клетка не будет делиться, то она не представляет угрозы, и не будет трансформироваться в опу-холь. Мутации в антионкогенах (их около 20) приводят к их инактивации. В норме они угнетают процессы пролиферации и усиливают апоптоз. Мутации в остальных генах человека к раку не приведут.
■ Для развития рака необходимо от 3 до 7 мутаций, в среднем 4 мутации в 3-4-х генах. Одна мута-ция к развитию рака не приведет.
■ Необходимым условием для возникновения раковой клетки является пролиферация мутировав-ших клеток, потому что эта мутация должна передаться по наследству.
■ Мутации могут быть в соматических клетках, могут изначально быть и в половых клетках. Пере-даются по наследству антионкогены. Плод выживает, растет, развивается. При мутации в онко-генах плод не развивается. Если ребенку передается наследственная мутация в антионкогене, то эта мутация будет во всех соматических клетках. Это предрасположенность к раку, но не рак. Но ребенок рождается уже с одной мутацией, и накопить критическое число мутаций ему нужно го-раздо меньше времени. Поэтому универсальное свойство наследственно-предрасположенных ра-ков – это молодой возраст заболевших. Рак молодых может быть еще при очень большой канце-рогенной нагрузке. Таким образом, рак – это генетическая болезнь. Следовательно, рак не заразен.
■ Прицельная биопсия – с помощью биопсийных щипцов (фарцепт) из наиболее подозрительных участков для гистологического исследования
■ Brush-биопсия – забор (соскоб) материала для цитологического исследования с помощью специ-альной щетки – при бронхоскопии
■ Пункционная биопсия – с помощью специальной иглы на конце катетера, вводимого через биоп-сийный канал эндоскопа.
■ Аспирация содержимого полых органов и/или смывы с поверхности пораженного участка с по-мощью катетера.
■ Трепан-биопсия – применение специальной иглы с режущим механизмом, находящимся в про-свете иглы, позволяет взять «стобик» ткани из опухоли.
■ Инцизионная биопсия – забор материала в центре или по периферии новообразования. Забор биопсии на достаточную глубину (не менее чем на 2-3 мм)
■ Эксцизионная биопсия – полное радикальное удаление опухоли при ее небольших размерах (невусы, папилломы, лейкоплакии, эрозии)
■ Интраоперационная биопсия
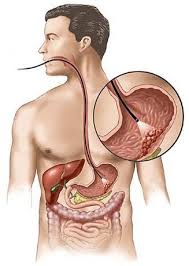 ЭФГДС
ЭФГДСПротивопоказания:
• Острый инфаркт миокарда
• Инсульт
• Сердечно-сосудистая недостаточность III степени
• Психические заболевания в стадии обострения
• Лордоз, кифоз
• Острое воспаление миндалин (ангина)
• Артериальная гипертензия II-III ст.
• Расширение вен пищевода.
■ Ректороманоскопия – диагностика рака прямой и дистальной части сигмовидной кишки.