Почти в каждой домашней аптечке имеется пузырёк 3-процентного раствора перекиси — пероксида водорода Н2О2. Его используют для дезинфекции ран, остановки кровотечений.
Каков механизм действия препарата? Входящий в состав плазмы крови фермент каталаза (белок, содержащий железо) вызывает каталитическое разложение пероксида:
2Н2О2=2Н2О + О2.
Выделяющийся при этом кислород убивает микроорганизмы и закупоривает сосуды, тем самым способствуя прекращению кровотечения. Интересно, что реакция разложения пероксида ускоряется и при внесении в раствор некоторых соединений переходных металлов, например оксида марганца (IV) MnO2, дихромата калия К2Сr2О7.
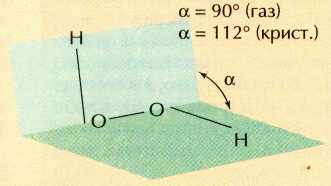
Чистый пероксид водорода представляет собой бесцветную жидкость с температурой плавления -0,41 °С; он не-
ограниченно смешивается с водой, растворяется в этиловом спирте и эфире. Вещество устойчиво лишь в темноте и в отсутствие примесей: даже ничтожные количества ионов переходных металлов вызывают его разложение, приводящее к взрыву. Поэтому промышленность обычно выпускает 30-процентный раствор пероксида, называемый пергидролем. Но и с ним обращаться нужно крайне осторожно: при попадании на кожу пергидроль вызывает ожоги. А если вы нечаянно глотнули раствор перекиси, необходимо немедленно выпить побольше воды, принять рвотное средство и вызвать врача.
В пероксиде водорода валентность не совпадает со степенью окисления. Атомы кислорода в нём образуют по две ковалентные связи, т. е. двухвалентны. Если же подсчитать их формальный заряд (степень окисления), то он окажется равным -1: H+12O-12.
Поэтому вещество может проявлять свойства как окислителя:
H2O-12+2KI+ H2SO4=I2+K2SO4+2Н2О-2,
так и восстановителя:
2КMnО4+5H2O-12+3H2SO4= 2MnSO4+5О02+K2SO4+8Н2О.
Подобно тому как в воде атомы водорода способны замешаться на активный металл, из пероксида водорода могут быть получены пероксиды металлов, например гидрат пероксида кальция:
Са(ОН)2+Н2О2+ 6Н2О=СаО2•8Н2О.
Похожие статьи