Сероводород H2S — бесцветный газ (tпл=-86 °С, tкип=-60 °С) с характерным резким запахом тухлых яиц (строго говоря, не сероводород пахнет тухлыми яйцами, а тухлые яйца пахнут сероводородом, который выделяется при разложении серосодержащих белков), немного тяжелее воздуха, малорастворимый в воде. При 20 °С в 100 мл воды растворяется 2,6 мл H2S. Сероводород необычайно ядовит: отравление возникает уже при его концентрации в воздухе около 200 мг/м3, а даже один вдох чистого H2S смертелен! Опасность усугубляется тем, что при концентрациях более 225 мг/м3 человек перестаёт ощущать запах сероводорода из-за паралича органов обоняния. При отравлении пострадавшего необходимо немедленно вывести на свежий воздух и вызвать врача.
Сероводород встречается в природе, как правило, над нефтью или в виде примеси к природному газу. Им могут быть заполнены пещеры, гроты. Небольшое количество этого газа в растворённом виде содержится в воде серных источников. Наиболее известные из них — курорт Мацеста вблизи города Сочи, а также Кавказские Минеральные Воды. Значительные количества H2S выделяются в атмосферу в результате вулканической деятельности.
В лаборатории сероводород получают действием разбавленной (20 %) серной кислоты на сульфид железа: FeS+H2SO4=FeSO4+H2S. Удобным методом получения сероводорода служит нагревание смеси серы с парафином.
При горении H2S на воздухе образуется сернистый газ: 2H2S+3О2= 2SO2+2H2O. Если в пламя горящего сероводорода внести холодный предмет, например фарфоровую чашку, то она покроется тонким налётом серы — продукта неполного окисления
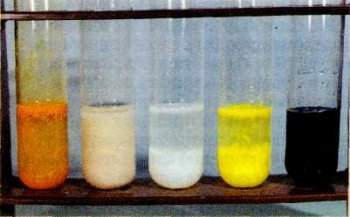
При взаимодействии сероводорода или раствора сульфида натрия с солями металлов образуются осадки сульфидов. Многие из них имеют характерную яркую окраску. Эта особенность используется в химическом анализе. Например, сульфиды меди, свинца и железа окрашены в чёрный цвет, кадмия — в жёлтый, сурьмы — в оранжевый, марганца — в бледно-розовый, а цинка — в белый. На фото — осадки Sb2S3, MnS, ZnS, CdS, FeS.
Похожие статьи