Оксид углерода(IV), углекислый газ, был впервые описан известным ятрохимиком Яном Баптистом ван Гельмонтом (1579—1644), который наблюдал его образование при сжигании древесного угля, в результате спиртового брожения и при действии кислот на известняк СаСО3 и поташ К2СО3. Он обнаружил присутствие этого газа в минеральной воде и в желудке человека. Английский химик Джозеф Блэк (1728—1799) называл углекислый газ «фиксируемым воздухом» на том основании, что он легко поглощается щелочами.
Оксид углерода (IV) — это бесцветный газ без запаха, малорастворимый в воде (171,3 мл в 100 мл воды при 0 °С, 87,8 мл при 20 °С). Растворимость его резко возрастает при повышении давления, что используется в приготовлении газированных напитков. При температуре -78,5 °С углекислый газ замерзает, образуя белые кристаллы «сухого льда». «Сухой лёд» служит для охлаждения продуктов, например мороженого. Если бросить кусочек «сухого льда» в воду, он начнёт с шипением «таять», возгоняясь, т. е. переходя в газообразное состояние, минуя жидкое. Жидкий СО2 можно получить при комнатной температуре и высоком давлении.
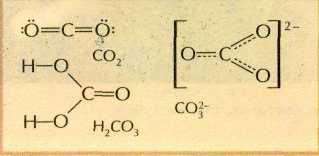
При 20 °С жидкий углекислый газ представляет собой подвижную бесцветную жидкость с плотностью 0,77 г/см3, плохо растворимую в воде.
Раствор углекислого газа в воде проявляет свойства слабой и неустойчивой в водных растворах угольной кислоты Н2СО3. Саму кислоту лишь недавно удалось выделить в индивидуальном виде при низких температурах. Её соли — карбонаты, напротив, достаточно устойчивы. Например, карбонат натрия Na2CO3 плавится без разложения при 858 °С.
Углекислый газ практически не проявляет окислительных свойств, не поддерживает горения и дыхания. Но бывают и исключения. Если внести в цилиндр с углекислым газом горящую магниевую ленту, магний какое-то время продолжает гореть и в атмосфере СО2: 2Mg+СО2=2MgO+С, но вскоре реакция прекращается.
Углекислый газ проявляет свойства кислотного оксида. Он легко вступает в реакцию с щелочами, что наблюдал в своих опытах ещё Блэк. Так, при пропускании углекислого газа через раствор щёлочи вначале образуется средний карбонат (стиральная сода): 2NaOH+СО2=Na2CO3+H2O, который затем переходит в кислый (питьевую соду):
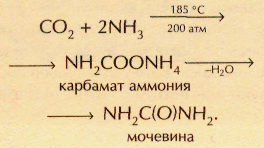
Na2CO3+СО2+Н2О=2NaHCO3.
В атмосфере Земли содержится около 2,3•1012 т углекислого газа, ещё больше (1,3•1014 т) растворено в воде. Это количество постоянно возрастает за счёт промышленных выбросов и работы транспорта.
Значительные количества промышленных выбросов углекислого газа (примерно 50%) поглощаются зелёными растениями. Они преобразуют СО2 в углеводы, выделяя свободный кислород (процесс фотосинтеза). Около 30% выбрасываемого в атмосферу углекислого газа растворяется в Мировом океане.
Небольшое количество углекислого газа в воздухе благоприятно сказывается на дыхании, так как его молекулы стимулируют дыхательный центр головного мозга. Повышенное же содержание СО2 опасно для здоровья человека: в высоких концентрациях углекислый газ тормозит процессы дыхания и обмена веществ. Углекислый газ в полтора раза тяжелее воздуха и, следовательно, накапливается в подвалах, на дне пещер. Известны случаи отравления этим веществом со смертельным исходом.
В промышленности углекислый газ получают при обжиге известняков и доломитов. Он находит применение в производстве соды, свинцовых белил, как инертная среда для проведения многих химических реакций. Значительное количество СО2 расходуется на производство карбамата аммония (соли неустойчивой карбаминовой кислоты NH2COOH), из которого получают мочевину (карбамид) — ценное азотное удобрение:
Похожие статьи