Наша планета окружена атмосферой — воздушной оболочкой, простирающейся от поверхности Земли более чем на полторы тысячи километров. Масса этого воздушного океана внушает уважение — 5•1015 т! Воздух представляет собой сложный, многокомпонентный газовый «коктейль», который помимо основных составляющих — азота и кислорода — включает аргон, углекислый газ, водяные пары, мельчайшие твёрдые частицы (пыль), капельки воды, а также незначительные примеси многих других веществ (SO2, CH4, NH3, СО, HF, H2, H2S и т. д.).
Важнейшей частью воздуха является кислород, необходимый для дыхания как животным, так и растениям.
Вдыхаемый нами кислород идёт на окисление сложных органических молекул — углеводов и жиров — до углекислого газа и воды. Эти реакции сопровождаются выделением и накоплением энергии и протекают с участием белковых катализаторов -ферментов (см. статью «Ферменты -на все руки мастера»).
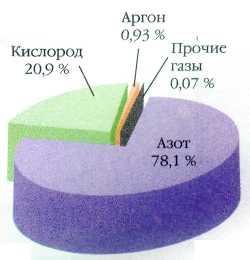
Состав атмосферы Земли.
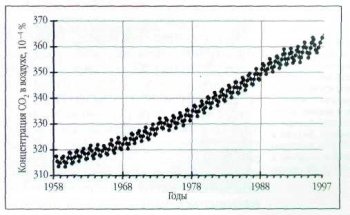
К моменту появления человека углекислый газ, так необходимый растениям, уже стал дефицитом. Его концентрация в воздухе до начала промышленной революции составляла всего 0,029%. Однако в последние полтора столетия из-за сжигания ископаемого топлива и уничтожения лесов содержание СО2 в атмосфере повышается. По данным американской обсерватории Мауна-Jloa (Гавайские острова), только с 1958 по 1997 г. среднегодовая концентрация СО2 в воздухе выросла с 0,0315 до 0,03б5%.
Находящиеся в воздухе азот и аргон играют роль балласта, а содержание других газов совсем незначительно и измеряется сотыми и тысячными долями процента. Два самых лёгких — водород и гелий — не могут удерживаться земным тяготением, поэтому, попав в атмосферу (водород — в результате вулканической деятельности, гелий — вследствие распада радиоактивных элементов), они довольно быстро улетают в космос. Аммиак NH3 и хлороводород очень хорошо растворяются в воде, поэтому с дождями они попадают в почву, где аммиак усваивается растениями, а хлороводород реагирует с минеральными веществами. Сероводород под действием света окисляется до оксида серы(IV): 2H2S+3О2= 2Н2О+2SO2, который в присутствии кислорода воздуха и паров воды превращается в серную кислоту. Последняя в значительной степени нейтрализуется присутствующим в воздухе аммиаком.
Похожие статьи