Каких свойств веществ чаще всего хотят добиться химики-неорганики? В большинстве случаев — экстремальных. Вспомним, что львиная доля процессов с участием органических соединений (за исключением, может быть, полимеров), протекает в условиях, близких к биологическим, — в очень ограниченном интервале температур и давлений. Многие органические вещества не выдерживают температур выше 200—300 °С и давлений больше нескольких сот атмосфер — дальше происходит разложение. А если нужен материал, работающий в жёстких условиях, за дело берётся неорганическая химия.
Примером может служить история создания специального покрытия для спускаемых космических аппаратов. Снижаясь, они входят в плотные слои атмосферы с высокой скоростью. От трения о воздух поверхность аппарата разогревается до огромной температуры — тут будет уничтожено всё, что может гореть. Значит, материал должен быть устойчивым к окислению, тугоплавким и обладать низкой теплопроводностью — ведь в спускаемом отсеке будет находиться чувствительное научное оборудование или даже живые существа.
Ясно, что вещества, из которых можно изготовить такое покрытие, следует искать среди тугоплавких оксидов, не забывая при этом ни об их химических свойствах (скажем, СаО или ВаО плавятся при очень высоких температурах — 2600 и 1920 °С соответственно, но в природных условиях не проявляют никакой химической устойчивости), ни о теплопроводности, ни, наконец, о стоимости. И решение было найдено: покрытие некоторых летательных аппаратов сделано из керамики на основе одного из самых инертных и в то же время достаточно тугоплавких оксидов — Та2О5 (tпл=1890 °С).
Большие задачи ставит перед неорганической химией и электроника. Ей нужны не только сверхчистые кремний и германий, но и вещества с нестандартными и очень сложными диэлектрическими свойствами, например сегнетоэлектрики.
Если сегнетоэлектрик поместить на некоторое время во внешнее электрическое поле, он становится самостоятельным источником поля, подобно намагниченному куску железа. Если затем поменять внешнее поле на противоположное, скачком изменится и собственное поле сегнетоэлектрика. Как и у магнита, оно может сохраняться и в отсутствие внешнего поля, причём очень долго. Возник вопрос а можно ли использовать это явление в электронике? Разумеется, ответили учёные, — в первую очередь там, где требуется сохранять информацию, например в устройствах памяти. Необходимо лишь подыскать вещество — основу будущего материала. Есть сегнетоэлектрики как органические, так и неорганические. Но первые могут работать лишь в узком интервале температур, да и не очень устойчивы даже при обычных условиях: обыкновенная плесень способна вывести их из строя. Поэтому выбор пал на неорганических «претендентов».
Где их искать? Здесь химику-неорганику приходит на помощь накопленный наукой опыт. Известно, что сегнетоэлектрическими свойствами обладают соединения с кристаллической структурой, близкой титанату кальция (перовскиту СаTiO3). Благо, таких соединений не очень много — их перебрали одно за другим. Выяснилось, что наилучшие свойства проявляют вещества, содержащие висмут. Круг поисков сузился — и вот результат: соединение SrBi2Nb2O9 уже используется в новом поколении устройств памяти.
Ни для кого не секрет, что именно в «неорганической команде» собрались чемпионы-сверхпроводники. Все они — соединения меди, а сверхпроводящие свойства обеспечивают медь-кислородные слои [CuО2], которые присутствуют в структурах этих соединений. Однако добиться хорошей сверхпроводимости не так-то просто. Природа ставит два условия: определённая (нецелочисленная) степень окисления меди, чуть больше 2, и очень узкий диапазон длин связей медь — кислород. Какой должна быть кристаллическая структура соединения, чтобы эти условия оказались выполненными? Приходится учитывать и размеры ионов, и предпочтительность той или иной степени окисления, и даже то, к какому координационному окружению тяготеет тот или иной ион. А ведь отталкиваться здесь химику не от чего: все сверхпроводники — дети XX столетия! Приходится руководствоваться в основном интуицией. Пока удалось достичь перехода в сверхпроводящее состояние при температуре -93 °С, но физики утверждают, что это не предел. Ведь исследованы далеко не все возможности, и не исключено, что мечта экспериментаторов — сверхпроводимость при комнатной температуре — сбудется.
Большую роль в химии играют металлокомплексные катализаторы — комплексы металлов (как правило, переходных, но не всегда) с различными лигандами. Уникальными свойствами обладает комплекс осмия (III) [Os(NH3)5(CF3SO3)]2+. Пять из шести координационных мест в нём заняты молекулами аммиака, а шестое — ионом трифторметилсульфоната, который осмий при восстановлении очень легко теряет. Образующийся ион [Os(NH3)5]2+ исключительно химически активен. Он «вцепляется» даже в очень стабильную молекулу бензола. В образовавшемся веществе атом осмия оказывается химически связанным лишь с одной кратной связью в бензольном ядре. Две оставшиеся двойные связи могут легко присоединить Н2, как обычные ненасыщенные соединения. Это позволяет превратить бензол в циклогексен с высоким выходом.
А вот совсем «свежая», ещё не решённая до конца задача для неорганического синтеза. Рассмотрим атом какого-нибудь очень активного металла, помещённый в большую полую молекулу, иными словами, в «клетку» (так эти молекулы, кстати, и называются). Атом может легко терять электроны: они переходят сначала к молекуле-клетке, а потом и в реакционную среду. Вещество превращается в активнейший восстановитель, который после использования легко отделить от реакционной смеси. Но «загнать» атом металла в клетку — дело сложное. Простейшая клетка такого типа — фуллерен, и атом, скажем, лантана по размерам вполне подходит для этого. Однако процесс идёт в жёстких условиях — графит пропитывают раствором какой-нибудь соли лантана и под действием лазера испаряют. Естественно, в таких условиях получить чистое вещество невозможно: его образуется не более 40%, а остальное — разнообразные примеси, которые ещё требуется отделить.
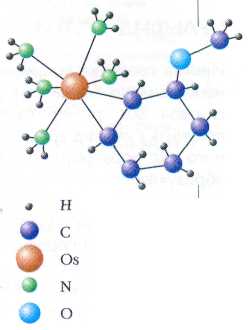
Подвергнутый гидрированию комплекс [Os(NH3)5]2+ с анизолом (метиловым эфиром фенола). Этот ион легко отщепляет [Os(NH3)5]2+, образуя молекулу 3-метоксициклогексена — продукт частичного гидрирования анизола.
Сейчас химикам известно и то, что очень похожие клетки способны образовывать гидриды бора, например [В10Н10]2- или [В12Н12]2-. Эти ионы устойчивы даже в водном растворе. В кислой среде клетка «раскрывается», и образуется полость, в которую мог бы «зайти» какой-нибудь ион. Если потом раствор подщелочить, клетка снова «захлопнется». Но ввести внутрь такой клетки атом металла ещё только предстоит. Ныне способы работы с веществом подобны операции на живой клетке, только на уровне отдельных молекул. Они открывают возможности проведения реакций с высоким выходом продукта и в достаточно мягких условиях. Разработка этих методов и является задачей современного неорганического синтеза.
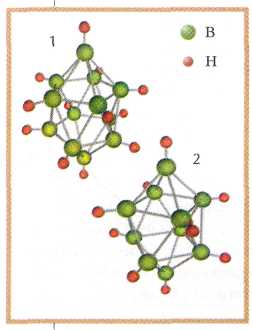
Строение ионов:
[B12H12Р]2-(1),
[В10Н10]2-(2).
Похожие статьи