Древние философы относили воздух к числу важнейших стихий, из которых построен мир. Леонардо да Винчи (1452—1519), изучая процессы горения, отмечал, что воздух состоит из различных «частей» (веществ), но только одна из них расходуется при горении. Подобную мысль высказывали и другие учёные XVI—XVIII вв. Однако кислород открыли лишь в 70-х гг. XVIII столетия независимо друг от друга английский химик Джозеф Пристли и его шведский коллега Карл Шееле.
Шееле в 1771 —1773 гг. получал «огненный воздух», как он назвал кислород, при прокаливании различных солей, например калийной селитры, при 400—500 °С: 2KNO3=2KNO2+O2. Учёный впервые описал свойства данного газа. Однако его «Химический трактат о воздухе и огне» увидел свет лишь в 1777 г., а Пристли опубликовал результаты своих опытов раньше — в 1774 г.
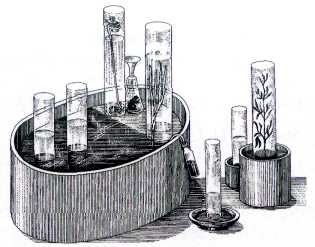
Приборы Дж. Пристли.
Жидкий кислород.
Пристли выделял кислород (который он именовал «дефлогистированным воздухом»), нагревая оксид ртути: 2HgO=2Hg+O2. Для этого в кристаллизатор, наполненный ртутью, он помещал перевёрнутый вверх дном стеклянный цилиндр с оксидом ртути. Фокусируя с помощью большой линзы солнечные лучи на верхнюю часть цилиндра, учёный наблюдал, как образующаяся ртуть стекала в кристаллизатор, а цилиндр наполнялся бесцветным газом. Позднее Пристли обнаружил, что вместо оксида ртути можно использовать и сурик
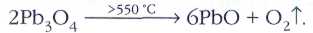
В атмосфере газа, полученного Пристли и Шееле, свеча горела интенсивнее, чем на воздухе, а тлеющая лучинка вспыхивала ярким пламенем. Лавуазье включил новый элемент в список простых веществ (простых тел) и дал ему название Oxygenium (от греч. «оксис» — «кислый» и «геннао» — «рождаю») — «рождающий кислоты», поскольку считал, что свойства кислот обусловлены присутствием в них атомов кислорода. Открытие кислорода позволило правильно описать процессы горения различных веществ.
Кислород широко распространён в природе. В свободном виде он содержится в воздухе (21% по объёму), в составе различных соединений (оксидов, солей) — в земной коре (47%). Пожалуй, самым известным его соединением является вода. Многие органические вещества (спирты, кислоты, жиры, белки, углеводы) также содержат кислород. Подсчитано, что в организме человека массой 70 кг 43 кг приходится на атомы кислорода. Взрослый человек за сутки потребляет в среднем 100 л кислорода.
Кислород — один из самых активных элементов-неметаллов. Напрямую он не взаимодействует лишь с благородными газами, галогенами (кроме фтора), серебром, золотом, некоторыми платиновыми металлами. Низшие оксиды, такие, как МnО, СО, NO, реагируют с кислородом с образованием оксидов Мn3О4, СО2, NO2. Многие органические вещества (за исключением отдельных галогенопроизводных, например хлороформа СНСl3) сгорают в атмосфере кислорода. Дерево, шерсть, сено, навоз при хранении на воздухе подвергаются гниению — медленному окислению, часто посредством микроорганизмов. При гниении, как и при горении, выделяется тепло.
В промышленности кислород получают перегонкой сжиженного воздуха, который охлаждают примерно до -200 °С, а затем постепенно повышают температуру. При -19б°С начинает испаряться азот, а жидкий воздух обогащается кислородом. Раньше кислород выделяли из воздуха при помощи оксида бария — вещества, способного обратимо присоединять кислород. В лабораториях небольшие количества кислорода получают из бертолетовой соли KСlO3, пероксида водорода или перманганата калия, который разлагается по реакции
2КМnО4 ®230°С К2МnО4+МnО2+О2.
Воздух и чистый кислород широко применяются в промышленности: для получения искусственного жидкого топлива, смазочных масел, азотной и серной кислот, в металлургии — для обжига руд и для окисления примесей в расплавленном металле. В процессах сварки и резки металлов, плавления тугоплавких веществ (например, кварца) используют высокую (до 3000 °С) температуру горения ацетилена в кислороде. Жидкий кислород служит окислителем ракетного топлива. При некоторых заболеваниях врачи рекомендуют больным дышать воздухом, обогащённым кислородом.
Всякая быстро совершающаяся реакция называется горением, если она сопровождается столь большим отделением тепла, что происходит накаливание. Так, многие металлы горят в хлоре, окись натрия или бария горит в углекислом газе, порох горит от искры и т. п. Очень многие тела горят в кислороде, а от его присутствия и в воздухе. Для начала горения необходимо обыкновенно накалить горючее вещество или только некоторую часть его (до температуры самовоспламенения или поджечь его. — Прим. ред.). Для продолжения горения нет нужды в новом накаливании, потому что при самом горении отделяется такое количество тепла, которое достаточно для надлежащего накаливания дальнейших частей горючего вещества.
Д. И. Менделеев. «Основы химии»

Похожие статьи