К концу XIX в. дружными усилиями физиков и химиков была разработана важнейшая глава физической химии — учение о равновесиях химических реакций, или химическая термодинамика. Одновременно с учением о равновесиях создавалась теория о скоростях химических процессов — химическая кинетика. Накопленные ко второй половине XIX в. многочисленные экспериментальные данные и сформулированные на их основе закономерности (закон действующих масс, уравнение Аррениуса) считались твёрдо установленными. Тем не менее время от времени появлялись факты, которые невозможно было объяснить ни одной из существовавших теорий. Едва ли не самой загадочной оказалась очень простая с виду реакция водорода с хлором: Н2+Сl2=2НСl, которая может идти при нагревании либо при облучении светом. В последнем случае реакцию называют фотохимической (от греч. «фотос» — «свет»).
Механизм цепного процесса подобен эффекту домино. Зарождение, рост и обрыв цепи.
В 1845 г. английский химик Джон Дрепер (1811 — 1882) установил, что под действием солнечного света хлор приобретает особую активность в реакции с водородом. Учёный считал, что «активный хлор» — особая разновидность хлора. Однако впоследствии было доказано, что никаких особых «модификаций» газообразный хлор не имеет. Ещё более удивительный факт обнаружили в 1857 г. немецкий химик Роберт Вильгельм Бунзен (1811 — 1899) и его ученик из Англии Генри Энфилд Роско (1833—1915). Выяснилось, что некоторые примеси даже в самых малых концентрациях могут оказать огромное влияние на скорость этой реакции. Например, кислород очень сильно замедлял её — в сотни раз при увеличении его концентрации с 0,01 до 1 %, Это был парадоксальный результат, не поддающийся объяснению: ведь кислород сам прекрасно реагирует с водородом. Столкнулись исследователи и с другими непонятными явлениями. В частности, скорость реакции зависела от материала, из которого сделан сосуд, и даже от его размеров. В стройном, казалось бы, учении о скоростях реакций появилась брешь, и никто не знал, как же её закрыть.
Как заметил (хотя и по другому поводу) английский химик, лауреат Нобелевской премии Сирил Норман Хиншелвуд (1897—1967), «ситуация здесь аналогична той, которая обычна в исследованиях по психологии: большую часть сомнительных данных можно исключить, но часто остаётся маленький упрямый фактик, с которым не так-то просто справиться». А реакция водорода с хлором преподносила всё новые сюрпризы...
В начале XX в. Альберт Эйнштейн сформулировал для фотохимических реакций закон квантовой эквивалентности: каждый поглощённый квант света (фотон) вызывает изменения лишь в одной молекуле. Экспериментально несложно измерить число поглощённых в реакции квантов света и число прореагировавших (или образовавшихся) молекул. Отношение этих величин называется квантовым выходом реакции. И если каждая поглотившая квант света молекула превращается в одну молекулу продукта, квантовый выход равен единице. Однако экспериментально измеренные квантовые выходы различных фотохимических реакций сильно различались. Некоторые из них оказались меньше единицы, другие — больше. Это не согласовывалось с законом Эйнштейна.
Ситуация резко изменилась в 1913 г., когда один из основоположников химической кинетики немецкий химик Макс Боденштейн измерил квантовый выход фотохимической реакции Н2+Сl2=2НСl. Результат оказался невероятным: число молекул НС1, образовавшихся при поглощении смесью одного кванта света, иногда достигало миллиона! Учёный объяснил столь поразительный эффект следующим образом: каждый поглощённый смесью квант света «запускает» длинную цепочку превращений, в которой реагируют сотни тысяч молекул исходных веществ, превращаясь в молекулы продукта реакции. Это подобно тому, как выстроенные в ряд (или змейкой) костяшки домино быстро, словно по команде, падают одна за другой, если толкнуть первую из них.
Цепной механизм реакции получил блестящее экспериментальное подтверждение. Известно, что если газ нагревать неравномерно, в нём образуются горячие струи, которые можно сфотографировать. Химики знали также, что в реакции водорода с хлором выделяется много теплоты. Смесь водорода с хлором облучали очень короткой (несколько стотысячных долей секунды) вспышкой света от электрической искры и затем фотографировали. Обнаружилось, что спустя 0,0025 с струй на снимках ещё нет, потом они появляются, достигают максимума через 0,01 с и вновь исчезают. Это означает, что в момент вспышки и сразу после неё, в течение нескольких тысячных долей секунды, реакция практически не идёт. Она развивается уже после того, как искра потухла. Единственным объяснением может служить цепной механизм, согласно которому свет только начинает реакцию, продолжаться же какое-то время она может сама.
Если смесь нагрета несильно или интенсивность света невелика, реакция идёт спокойно. Основываясь на этом факте, Боденштейн выдвинул очень важный принцип стационарной концентрации промежуточных продуктов: скорость генерирования активных частиц на стадии зарождения цепной реакции равна скорости исчезновения активных частиц на стадии обрыва. Действительно, если бы скорость обрыва была больше скорости зарождения цепей, то число активных частиц снизилось бы до нуля и реакция прекратилась сама собой. А в случае преобладания скорости зарождения число активных частиц должно расти со временем, что привело бы к взрыву.
Теория цепей хорошо объясняла особенности протекания реакции водорода с хлором (и некоторых других сходных реакций). Дело оставалось лишь за тем, чтобы выяснить химический механизм для каждой стадии реакции. Учитывая уровень
знаний того времени, это оказалось трудной задачей, и сам Боденштейн с ней полностью справиться не сумел. Вначале он считал, что кванты света выбивают из молекул хлора электроны, которые и являются активными частицами. Далее электрон захватывается нейтральной молекулой хлора, так что она становится активной и способной к реакции с молекулой водорода. В этой реакции образуются молекула НСl и новый свободный электрон. Обрыв цепи происходит, когда электрон захватывается молекулой примеси или стенкой сосуда. Чем меньше размеры сосуда и чем ниже в нём давление, тем легче электрону добраться до стенки. Тем самым удалось объяснить необычное действие малых концентраций «посторонних» веществ, а также влияние материала и размеров сосуда. Всё было хорошо, кроме одного: измерения электропроводности облучаемой светом реакционной смеси показали, что никаких зарядов в ней не возникает и, следовательно, никаких свободных электронов не образуется. Надо было искать другие объяснения.
Спустя три года Боденштейн придумал новый механизм. Молекула хлора, поглотившая квант света, становится настолько активной, что легко реагирует с молекулой водорода. При продолжении цепи эта избыточная энергия через возбуждённые молекулы НСl снова передаётся молекулам Сl2. Здесь на помощь первичной энергии квантов света приходит энергия, выделяющаяся в каждом звене цепи. Если звёздочкой обозначить возбуждённые молекулы, схему энергетической цепи можно представить так:
Вторая и третья реакции повторяются много раз, пока какая-нибудь возбуждённая молекула не растратит бесполезно свою энергию и не оборвёт цепь. Механизм энергетических цепей, хотя и не подтвердился для данной реакции, оказался верным для других процессов — с участием фтора, открытых лишь полвека спустя!
Горение водорода в хлоре.
Вальтер Нернст.
В 1918 г. немецкий физикохимик, лауреат Нобелевской премии Вальтер Нернст предложил свой механизм этой реакции. Он предположил, что активными частицами являются атомы водорода и хлора:
(Неспаренный электрон часто обозначают точкой.) Обрыв цепей происходит, когда активные атомы Н или С1 реагируют с молекулами примеси, либо «прилипают» к стенке сосуда, либо взаимодействуют между собой (рекомбинируют), превращаясь в неактивные молекулы Н2 и Сl2. Схема Нернста была подтверждена разными экспериментами. Один из самых остроумных провёл английский физикохимик Майкл Поляни (1891 — 1976). В его опытах струя водорода проходила над слегка подогретым металлическим натрием и попадала в темноте в сосуд с хлором. Чистый водород с хлором при такой температуре не взаимодействует, но ничтожная примесь паров натрия полностью меняет дело: идёт быстрый
процесс образования хлороводорода. Здесь роль инициатора цепной реакции играет натрий: Na+Сl2®NaCl+Сl. Аналогичные результаты Поляни получил для реакции хлора с метаном. В этом случае стадии продолжения цепи выглядели так:
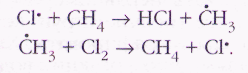
В рассмотренных цепных реакциях участвуют «осколки» исходных молекул — активные частицы — Н, Сl, СН3. Такие частицы, в которых один из электронов не имеет для себя пары, и потому обладающие очень высокой активностью, называются свободными радикалами. Впервые мысль об их существовании высказал ещё в 1900 г. американский химик-органик Мозес Гомберг (1866—1947), обнаруживший трифенилметильные радикалы (С6Н5)3С•, которые впоследствии были названы его именем.
После работ Гомберга естественно возник вопрос: является ли трифенилметил исключением, или в свободном состоянии могут существовать и другие «осколки» молекул, например метил СН3, или даже отдельные атомы — водорода, кислорода, серы и других элементов. Ответ на это дал в 1929 г. немецкий химик Фридрих Адольф Панет (1887— 1958), проведя со своим учеником Вильгельмом Хофедицем простой и красивый эксперимент. Газообразный азот под небольшим давлением пропускали через склянку, на дне которой находился тетраметилсвинец (СН3)4Рb — тяжёлая очень ядовитая жидкость. Азот насыщался её парами и с большой скоростью (от 12 до 16 м/с) проходил по длинной узкой трубке из жаростойкого кварцевого стекла; отдельные участки трубки могли нагреваться до температуры разложения тетраметилсвинца — приблизительно 450 °С. Далее азот увлекал продукты разложения в ловушку, охлаждаемую до очень низкой температуры.
том случае, когда в точке 2 получали свинцовое зеркало, и наоборот. Если точка 2 оказывалась слишком далеко от точки 1, то металлическое зеркало там оставалось нетронутым; однако можно было добиться его исчезновения, увеличив скорость потока газа через трубку.
Этот замечательный опыт наглядно показал, что при распаде тетраметилсвинца действительно образуются свободные метильные радикалы: (СН3)4Рb ® 4С•Н3+Рb. В токе инертного азота они могут «жить» некоторое время, а исчезают либо за счёт рекомбинации, превращаясь в этан: 2С•Н3®С2Нб, либо реагируя с металлическим зеркалом: 4С•Н3+Рb®(CH3)4Pb; 2C•H3+Zn ®(CH3)2Zn

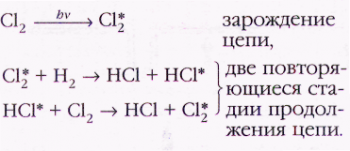



Похожие статьи