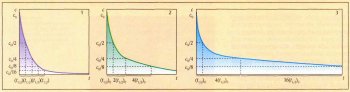
Зависимость концентрации реагента с от времени t для реакции первого порядка А®Р описывается формулой с=с0е-kt (с0 — начальная концентрация исходного вещества А, к — константа скорости реакции). Такая формула называется экспоненциальной, а соответствующая кривая — экспонентой (спадающей). Для реакции второго порядка А+®Р(в простейшем случае равенства концентраций реагентов А и В) скорость описывается уравнением w=dc/dt=-кс2 (знак «минус» показывает, что концентрация уменьшается со временем). Интегрирование этого уравнения дает иную зависимость концентрации реагента А (или В) от времени: 1/с-1/с0=kt, а соответствующая кинетическая кривая имеет гиперболическую зависимость (см. рисунок). Для реакций первого порядка период полупревращения t1/2 — величина постоянная: t1/2 =ln2/к.
А вот для реакций второго порядка период полупревращения зависит от исходной концентрации. Действительно, подставляя в формулу с=0,5с0 и t=t1/2, получим: t1/2=1/kc0. То есть по мере протекания реакции и уменьшения концентрации период полупревращения все время увеличивается.
Для реакции третьего порядка А+В+С ®Р зависимость скорости от концентрации, т. е. дифференциальная форма кинетического уравнения задаётся формулой w=dc/dt=-кс3 (при равных концентрациях всех исходных реагентов), а зависимость концентрации от времени (интегральная форма кинетического уравнения) описывается формулой 1/с2-1/с02=2kt. Время полупревращения для такой реакции равно 3/(2кс02). Кинетические кривые для реакций второго и третьего порядков приведены на рисунке.
Реакции второго и третьего порядков вначале могут идти быстро, но потом они резко замедляются, поскольку их скорость падает пропорционально соответственно квадрату и кубу концентрации. Это можно наглядно показать на таком примере. Пусть реакция считается законченной, когда израсходуется 99 % исходных веществ. Для реакции первого порядка время достижения 99-процентной степени превращения (когда с=0,01с0) равно -ln0,01/k, как нетрудно подсчитать по формуле с=c0e-kt. Следовательно, время окончания реакции больше времени полупревращения в -ln0,01/ln2=6,4 раза. Реакция второго порядка закончится за время 99/кс0, что больше времени полупревращения уже в 99 раз. Для реакции же третьего порядка время её завершения равно 9999/2kc20, а это в 3333 раза больше, чем время полупревращения!
Поэтому когда реакция третьего (и вообще высокого) порядка проходит на значительную глубину, может показаться, что она перестала идти...
Кинетические кривые для реакции первого (1), второго (2) и третьего (3) порядков.
Похожие статьи