Золотые украшения сохраняют свою красоту и блеск веками. А вот брошенный на улице старый автомобиль спустя несколько лет превращается в груду ржавого металлолома; долька яблока уже через несколько часов покрывается бурой плёнкой; петарда, брошенная в костёр, оглушительно взрывается.
Любопытно, что с точки зрения химической термодинамики возможны все перечисленные процессы, даже окисление золота. Просто у них разные скорости. Одной реакции требуются для завершения микросекунды, другой — миллионы лет. Почему так? Термодинамика ответить бессильна: в этой теории не учитывается время. Скорости химических реакций изучает химическая кинетика. Более того, химическая кинетика даёт ключ к управлению реакцией.
Для количественной характеристики скорости реакции используют не время её протекания, а другую величину — скорость изменения количества вещества (в молях) в единице объёма. Если за время At в объёме V образовалось Dn молей молекул продукта, то среднюю скорость реакции w можно определить как
Когда реакция идёт при постоянном объёме, её скорость выражают через изменение молярной концентрации (с=n/V) любого из продуктов или исходных веществ:
Для продукта реакции с2>с1, в случае же исходного вещества с2<c1 поэтому в выражение скорости ставят знак «-», чтобы величина w была положительна.
Надрезанное яблоко на воздухе быстро покрывается коричневой плёнкой органических полиоксидов.
Эти формулы позволяют рассчитать среднюю скорость реакции за любой временной промежуток, если известна зависимость концентрации от времени. При стремлении At к нулю получается формула для определения скорости в конкретный момент времени, которая равна производной от концентрации по времени:
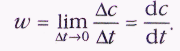
Так, для реакции 2N2O5=4NO2+О2
(квадратными скобками обозначены молярные концентрации).
Впервые скорость реакции и её зависимость от концентрации исходных веществ исследовал в 1850 г. немецкий химик Людвиг Фердинанд Вильгельми (1812—1864), который изучал гидролиз сахарозы в присутесли химическая реакция проходит с образованием газа, как растворение мела в кислоте:
СаСО3+2СН3СООН=(СН3СОО)2Са+СО2+Н2О,
то за ней удобно наблюдать, измеряя объём выделившегося газа. Когда в реакции участвует окрашенное вещество, за её ходом можно следить по изменению интенсивности окраски.
Иногда зависимость концентрации от времени определяют методом остановки реакции. Её, например, «замораживают», резко понижая температуру, и определяют, какие вещества и в каком количестве образовались к моменту остановки. Этот метод применим только для медленных процессов. Быстрые же анализируют не останавливая, путём измерения физических свойств продуктов реакции или реагентов по ходу реакции.
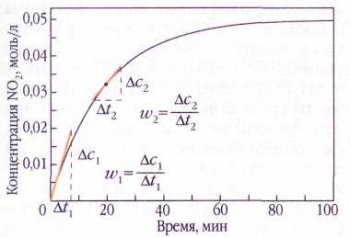
Графическое определение скорости образования NO2 при распаде N2O5. В начале реакции скорость больше, чем в середине процесса

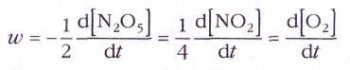
Похожие статьи