Впервые анатомическое строение двух венечных артерий описал Морганьи (Morgagni) еще в 1761 году. Современное представление об источниках кровообращения сердца остается практически неизменным, начиная с учебника Gray’s Anatomy, 1901 года издания. В научных публикациях по этому вопросу анатомами только детализировались индивидуальные варианты макроскопического строения венечных сосудов. В середине 60-х годов прошлого века благодаря широкому внедрению в практическое здравоохранение селективной коронарографии повышенный интерес к изучению этих сосудов стали проявлять не только анатомы, но также кардиохирурги и кардиологи. При этом in vivo было выявлено достаточно большое количество клинически релевантных вариантов строения, что вызвало дискуссию относительно того, какие из этих вариантов следует оценивать как проявление нормы, а какие – как сосудистые аномалии [7]. Однако, критерии «нормальности» венечных артерий до сегодняшнего дня не разработаны [1].
Существуют определенные несогласованности в номенклатурах, которые используются клиницистами и анатомами для обозначения ветвей венечных сосудов. Например, в руководствах по анатомии используется термин «венечные артерии», а в публикациях по хирургическому лечению ишемической болезни сердца – «коронарные артерии». Кроме того, практикующими кардиологами очень часто используются аббревиатуры английских названий артерий и их ветвей. Это обстоятельство, порою, затрудняет восприятие научных публикаций по актуальным вопросам кардиологии, особенно молодыми врачами, изучавшими морфологию венечных сосудов, используя классические учебники по анатомии. В этой связи, цель настоящей публикации – обобщить современные данные о наиболее часто встречающихся вариантах строения сосудов, кровоснабжающих сердце, сопоставив терминологии, которая применяется в анатомии и клинической практике.
Обычно сердце кровоснабжается двумя венечными артериями, устья которых располагаются в середине правого и левого синусов (синусы Вальсальвы) восходящей части аорты, вблизи свободного края полулунной заслонки клапана аорты [1, 4, 11, 41]. При компьютерной томографии правый синус выявляется со стороны грудины, левый направлен назад и влево. Задний (невенечный) синус находится со стороны межпредсердной перегородки. Уровень расположения устья артерий относительно синотубулярного соединения может варьировать в достаточно широком диапазоне (таблица 1).
Индивидуальные особенности уровня локализации устьев венечных артерий, а также их размеры следует учитывать при проведении коронарографии [18]. Сложности в манипулировании кончиком катетера обычно возникают при расположении устья венечной артерии выше створки клапана [17, 45].
Присутствие дополнительного отверстия на стенке восходящей аорты в области правого синуса может быть связано с самостоятельным отхождением ветви артериального конуса. Такой вариант встречается, в зависимости от популяции, с частотой от 7,1% случаев у жителей Германии [49] до 35,1% у жителей Кении [42] и 36,8% жителей Японии [30]. Наличие третьей венечной артерии создает определенные затруднения при вентрикулостомии и других кардиохирургических операциях [46]. Кроме того, этот сосуд в ряде случаев кровоснабжает не только артериальный конус, но также часть левого желудочка. Поэтому возникающие, при его поражении атеросклерозом или при спазме, клинические проявления ишемии миокарда могут неправильно интерпретироваться, как следствие поражения левой венечной артерии [40].
В области левого синуса аорты также может встречаться несколько отверстий, от которых берут начало сосуды, кровоснабжающие сердце. Cavalcani et al. [13] на выборке из 110 сердец взрослых людей в 1,82% случаев обнаружили, что огибающая и передняя межжелудочковая ветви начинаются от восходящей части аорты самостоятельными отверстиями. По данным Danias et al. [15] и Patel [34] самостоятельные отверстия этих двух ветвей обнаруживаются в 0.41–8% случаев. Отсутствие ствола левой венечной артерии обнаружили Topaz and al. [43] у 83 из 20.332 (0,4%) пациентов, которым проводилось ангиографическое исследование сосудов сердца. Авторы отмечают, что знание о существовании подобной аномалии важно для правильной интерпретации результатов коронарографии. Кроме того, при выполнении операций на сердце в условиях искусственного кровообращения в таком случае требуется селективная перфузия этих сосудов.

Левая венечная артерия (англ. left coronary artery, LCA) обычно начинается от аорты общим стволом, который разделяется на две ветви. Передняя межжелудочковая ветвь (син. левая передняя нисходящая артерия, англ. left anterior descending artery, LAD) по передней межжелудочковой борозде доходит до верхушки сердца. От нее начинаются ветвь артериального конуса, латеральная (диагональная) ветвь (количество варьирует от одной до трех) и перегородочные межжелудочковые (септальные) ветви. Обычно венечные артерии и их главные ветви лежит субэпикардиально. На рис. 1 демонстрируется феномен миокардиального мышечного мостика – сегмент передней межжелудочковой ветви лежит в толще миокарда. Клинически наличие миокардиального мостика часто ассоциировано со стенокардией, инфарктом миокарда, желудочковой тахикардией, а также с внезапной сердечной смертью [3]. Огибающая ветвь (син. левая огибающая артерия, англ. left circumflex artery, LCx) располагается в левой части венечной борозды. От нее берут начало от одной до трех левых краевых ветвей (син. ветвь тупого края, obtuse marginal branch, OMB), предсердные и предсердно-желудочковые ветви, а также задняя ветвь левого желудочка.
Горячева И. А. [2] выделяет три варианта архитектоники левой венечной артерии: (1) огибающая и передняя межжелудочковая ветвь имеют одинаковый диаметр (62% случаев); (2) преимущественное развитие передней межжелудочковой ветви (8%); (3) преимущественное развитие огибающей ветви (32%). Автор описывает также три варианта следования передней межжелудочковой и огибающей ветви. В первом варианте (62% наблюдений) передняя межжелудочковая артерия «исчезает» (вступает в толщу миокарда) на границе средней и нижней трети передней межжелудочковой борозды; во втором – достигает верхушки сердца (14% случаев); в третьем (24% изученных препаратов) – огибает верхушку сердца и простирается в заднюю межжелудочковую борозду в виде так называемой задней возвратной межжелудочковой артерии (рис. 2). «Короткая» огибающая ветвь, которая достигает только левого края сердца, где продолжается в левую краевую ветвь, встречается в 22% случаях (первый вариант). Почти в половине наблюдений (46%) этот сосуд огибает левый край сердца и разветвляется на его диафрагмальной поверхности на задние желудочные ветви (второй вариант). В 32% случаев огибающая ветвь ложится в заднюю межжелудочковую борозду, направляясь снизу вверх. При этом задняя межжелудочковая ветвь правой венечной артерии отсутствует. Такой вариант характерен для левого типа доминантности кровоснабжения сердца. При правом типе кровоснабжения задняя межжелудочковая ветвь является продолжением правой венечной артерии. При ко-
доминантном кровоснабжении сердца в формировании задней межжелудочковой артерии принимают участие обе венечные артерии. При определении доминантности учитывается также источник кровоснабжения предсердно-желудочкового узла. Данные о частоте встречаемости типов кровоснабжения сердца, которые основываются на анализе данных коронарографии, представлены в таблице 2. Обращает на себя внимание существенная разница статистических данных относительно частоты встречаемости левого типа кровоснабжения сердца при анатомических и клинических исследованиях. При этом следует заметить, что ангиография дает более достоверные данные относительно архитектоники сосудистого русла миокарда, т. к. позволяет выявлять внутримышечные сосуды и учитывать микроскопические анастомозы ветвей венечных артерий [32].
В литературе имеются данные, указывающие на то, что левый тип доминантности является достоверным прогностическим параметром не фатального инфаркта миокарда и общей смертности [48]. При левом типе доминирования до 90% крови направляется в левую венечную артерию, что создает повышенную нагрузку на интиму сосуда, особенно в местах его разветвления, что является одним из факторов риска развития атеросклероза [22]. При наличии короткого общего ствола левой венечной артерии нагрузки на интиму будут максимальными, поэтому такой вариант анатомического строения венечной артерии рассматривается как дополнительный фактор риска атеросклероза [21]. Коротким считается ствол, который имеет длину менее 5 мм и встречается такой вариант у 7–12% людей. Кроме атеросклероза короткий ствол левой венечной артерии может быть причиной блокады левой ножки пучка Гиса [29]. При коротком стволе левой венечной артерии катетер во время коронарографии может попасть в одну из ветвей, в результате чего не произойдет контрастирование всех сосудов бассейна этой артерии [38].
К вариантам анатомического строения левой венечной артерии относится ее деление не на две, а на три и более ветвей. В углу между передней межжелудочковой и огибающей ветвью нередко начинается добавочная терминальная ветвь (рис. 3). Этот сосуд называют – срединной (промежуточной) ветвью и рассматривается как аналог первой диа-
гональной ветви. Его калибр сопоставим с передней межжелудочковой ветвью, и может даже превосходить диаметр огибающей ветви. Данные о частоте встречаемости данного варианта анатомического строения
Правая венечная артерии (right coronary artery, RCA) располагается в правой части венечной борозды. Ее первой ветвью является ветвь артериального конуса1, второй, в 55–75% наблюдений, артерия синусно-предсердного узла [26, 28, 39]. Вблизи края сердца от нее берут начала от одной до трех правых краевых ветвей (син. ветвь острого края, acute marginal branch, AMB). После перехода на диафрагмальную поверхность сердца от правой венечной артерии начинаются предсердные ветви и задняя межжелудочковая ветвь (син. задняя нисходящая артерия, posterior descending artery, PDA).
Американской ассоциацией кардиологов (American Heart Association, AHA) предложено делить венечные артерии на сегменты. В правой венечной артерии выделяется четыре сегмента: проксимальный (на протяжении от устья сосуда до середины расстояния, который артерия проходит до правого края сердца); средний (от границы с первым сегментом до правого края сердца); дистальный (от правого края сердца до начала задней межжелудочковой ветви) и сегмент, соответствующий самой задней межжелудочковой ветви. В качестве самостоятельного сегмента рассматривается ствол левой венечной артерии (от места ее начала до ветвления на переднюю межжелудочковую и огибающую ветвь). В передней межжелудочковой ветви выделяется пять сегментов: проксимальный (до первой септальной/диагональной ветви); средний (от границы с предыдущим сегментом до второй диагональной ветви, т. е., примерно до середины расстояния от начала сегмента до верхушки
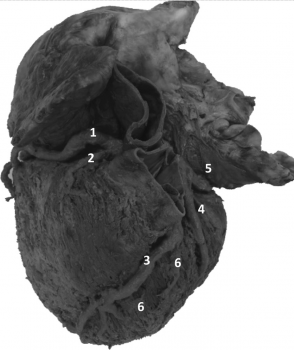
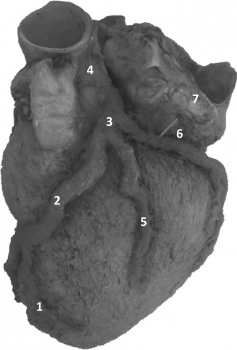
Рис. 4. Третья венечная артерия (ветвь артериального конуса): 1 – правая венечная артерия, 2 – ветвь артериального конуса, 3 – передняя межжелудочковая ветвь (левой венечной артерии), 4 – латеральная ветвь, 5 – огибающая ветвь (левой венечной артерии),
6 – перегородочные межжелудочковые ветви сердца); дистальный (от границы со средним сегментом до верхушки сердца), а также сегменты, соответствующие первой и второй диагональной артерии. В состав огибающей ветви входят пять сегментов: проксимальный (от бифуркации ствола левой венечной артерии до начала первой артерии тупого края); дистальный (начинается после отхождения первой артерии тупого края); сегменты, соответствующие первой и второй артерии тупого края, а также задней ветви левого желудочка.
Учитывая большое разнообразие вариантов архитектоники венечных сосудов, неоднократно предпринимались попытки определить, какой из вариантов следует принимать за норму. В качестве
«минимальных критериев» нормального строения этих сосудов Trivellato et al. [44] предложили следующие качественные параметры:
– правая венечная артерия лежит в венечной борозде, отделяющей правое предсердие от правого желудочка;
– левая венечная артерия начинается общим стволом, который лежит позади легочного ствола и разделяется на две ветви (переднюю межжелудочковую ветвь и огибающую ветвь2);
– передняя межжелудочковая ветвь расположена в одноименной борозде на грудино-реберной поверхности сердца и от нее начинаются перегородочные межжелудочковые ветви;
– огибающая ветвь проводит в (венечной) борозде между левыми предсердием и желудочком;
– задняя межжелудочковая ветвь начинается от правой или левой венечной артерии, лежит в одноименной борозде на диафрагмальной поверхности сердца и отдает перегородочные межжелудочковые ветви;
– сами венечные артерии и их крупные ветви лежат под эпикардом (экстрамурально).
Качественные и количественные критерии, свидетельствующие о «нормальности» венечных артерий у человека, которые предложены Angelini [5], представлены в таблице 4.
По сравнению с приведенными выше критериями нормального строения венечных артерий, варианты нормы в отношении этих сосудов варьируют в широком диапазоне. Считается, что любой вариант отхождения венечной артерии, ее хода и ветвления,
который встречается более чем у 1% людей сплошной выборки следует признавать нормой [5, 10, 14].
2 Названия сосудов приводятся в соответствии с Международной анатомической терминологией (Л. Л. Колесников, 2003).
В заключение следует отметить, что архитектоника венечных сосудов весьма вариабельная, индивидуальные особенности их анатомического строения выявляются не только на аутопсийном материале, но также in vivo с использованием современных диагностических технологий (селективной коронарографии, спиральной компьютерной томографии и др.). Наличие отдельных анатомических вариантов может рассматриваться как фактор риска возникновения и прогрессирования сосудистой патологии, в частности атеросклероза, с последующей ишемией миокарда.
Литература
1. Бокерия, Л. А., Беришвили, И. И. Хирургическая анатомия венечных артерий. – М.: Изд-во НЦССХ им. А. Н. Бакулева РАМН, 2003. – 297 с.
2. Горячева, И. А. Особенности архитектоники магистральных ветвей правой венечной артерии // Фундаментальная наука и клиническая медицина – человек и его здоровье: мат. XV Юбилейной Всерос. медико-биологической конф. молодых исследователей (с международным участием). – СПб.: Изд-во СПбГУ, 2012. – С. 81.
3. Бокерия, Л. А., Алекян, Б. Г. Тетвадзе, И. В. Ангиографическая диагностика миокардиальных мышечных мостиков // Сердечно-сосудистые заболевания. – 2011. – № 1 (12). – С. 102–109.
4. Целуйко, В. Н., Мищук Н. Е., Киношенко К. Ю. Аномалии строения коронарных артерий (часть 1) // Дiабет i сердце. – 2012. – № 10 (164). – С. 44–51.
5. Agelini, P. Congenital Heart Disease for the Adult Cardiologist Coronary Artery Anomalies An Entity in Search of an Identity // Circulation. – 2007. – Vol. 115 (10). – P. 1296–1305.
6. Ajayi, N. O., Lazarus L., Vanker E. A, Satyapal K. S. The prevalence and clinical importance of an «additional» terminal branch of the left coronary artery // Folia Morphol (Warsz). – 2013. – Vol. 72(2). – P. 128–131.
7. Angelini, P., Villason S., Chan A. V., Diez J. G. Normal and anomalous coronary arteries in humans // Coronary Artery Anomalies: A Comprehensive Approach / ed. by P. Angelini. – Philadelphia: Lippincott Williams & Wilkins, 1999. – P. 27–150.
8. Ballesteros, L. E., Ramirez L. M. Morphological expression of the left coronary artery: a direct anatomical study // Folia Morphol. – 2008. – Vol. 67(2). – P. 135–142.
9. Baptista, C. A., DiDio L. J., Prates J. C. Types of division of the left coronary artery and the ramus diagonalis of the human heart // Jpn Heart J. – 1991. – Vol. 32(3). – P. 323–335.
10. Becker, A. E., Anderson R. H. Coronary artery anomalies // Pathology of Congenital Heart Disease / eds.: A. E. Becker, R. H. Anderson. – London: Butterworths, 1981. – P. 369–378.
11. Berdajs, D., Turina M. Operative anatomy of the heart. Berlin [etc.]: Springer, 2011. P. 164–168.
12. Cademartiri, F., La. GL., Malago R., Alberghina F., Meijboom W. B., Pugliese F. [et al.] Prevalence of anatomical variants and coronary anomalies in 543 consecutive patients studied with 64-slice CT coronary angiography // Eur Radiol. – 2008. – Vol. 18 (4). – P. 781–791.
13. Cavalcanti, J. S., de Lucena Oliveira M., Paise Melo A. V., Jr. Balaban G., de Andrade Oliveira C. L., de Lucena Oliveira E. Anatomic variations of the coronary arteries // Arq. Bras. Cardiol. – 1995. – Vol. 65(6). – P. 489–492.
14. Click, R. L., Holmes Jr., Vlietstra R. E., Kosinski A. S., Kronmal R. A. Anomalous coronary arteries: location, degree of atherosclerosis and effect on survival – a report from the coronary artery surgery study // J. Am Coll. Cardiol. – 1989. – Vol. 13(3). – P. 531–537.
15. Danias, P. G., Stuber M., McConnell M. V., Manning W. J. The diagnosis of congenital coronary anomalies with magnetic resonance imaging // Coronary Artery Disease. – 2001. – Vol. 12(8). – P. 621–626.
16. Das Hirak Termination of left coronary in the population of Assam // Nat. J. Basic Med. Scien. – 2014. – Vol. 4(3). – P. 145–148.
17. Dombe, D. D., Anitha T., Giri P. A., Dombe S. D., Ambiye M. V. Clinically relevant morphometric analysis of left coronary artery // Int. J. Biol. Med. Res. – 2012. – Vol. 3(1). – P. 1327–1330.
18. Engel, H. J., Torres C. Major variations in anatomical origin of the coronary arteries-angiographic observations in 4,250 patients without associated congenital heart disease // Cathet. Cardiovasc Diagn. – 1975. – Vol. 116(5). – P. 157–169.
19. Eren, S., Bayram E., Fil F., Koplay M., Sirvanci M., Duran C. [et al.] An investigation of the association between coronary artery dominance and coronary artery variations with coronary arterial disease by multidetector computed tomographic coronary angiography // J. Comput Assist Tomogr. – 2008. – Vol. 32. – P. 929–933.
20. Fazliogullari, Z., Karabulut A. K., Unver Dogan N., Uysal I. I. Coronary artery variations and median artery in Turkish cadaver hearts // Singapore Med. J. – 2010. – Vol. 51 (10). – P. 775–80.
21. Gazetopoulos, N., Ioannidis P. J., Marselos A., Kelekis D., Lolas C., Avgoustakis D., Tountas C. Length of main left coronary artery in relation to atherosclerosis of its branches. A coronary arteriographic study // Br Heart J. – 1976. – Vol. 38 (2). – P. 180–185.
22. Ghaffari, S., Kazemi B., Dadashzadeh J., Sepehri B. The Relation between Left Coronary Dominancy and AtheroscleroticInvolvement of Left Anterior Descending Artery // Origin. J Cardiovasc Thorac Res. – 2013. – Vol. 5(1). – P. 1–4.
23. Goldberg, A., Southern D. A, Galbraith P. D., Traboulsi M., Knudtson, M. L., Ghali W. A. Coronary dominance and prognosis of patients with acute coronary syndrome // Am Heart J. – 2007. – Vol. 154 (6). – P. 1116–1122.
24. Hutchins, G. M, Nazarian I. H., Bulkley B. H. Association of left dominant coronary arterial system with congenital bicuspid aortic valve // Am J Cardiol. – 1978. – Vol. 42. (1). – P. 57–59.
25. Kalpana, R. A. Study On Principal Branches of Coronary Arteries In Humans // J. Anat. Soc. India. – 2003. – Vol. 52(2). – P. 137–140.
26. Kini, S., Bis K., Weaver L. Normal and Variant Coronary Arterial and Venous // Anatomy on HighResolution CT Angiography. AJR. – 2007. – Vol. 188. – P. 1665–1674.
27. Knaapen, M., Koch A. H., Koch C., Koch K. T., Li X., van Rooij P. C., Tijssen J. G., Peters R. J., van der Wal A. C., Damman P., de Winter R. J. Prevalence of left and balanced coronary arterial dominance decreases with increasing age of patients at autopsy. A postmortem coronary angiograms study // Cardiovasc Pathol. – 2013. – Vol. 22(1). – P. 49–53.
28. Krupa, U. The sinuatrial nodal artery in the human heart // Folia Morphol (Warsz). – 1993. – Vol. 52(1). – P. 29–37.
29. Lewis, C. M., Dagenais G. R., Friesinger G. C., Ross R. S. Coronary arteriographic appearances in Patients with Left Bundle-Branch Block // Circulation. – 1970. – Vol. 41(2). – P. 299–307.
30. Miyazaki, K. Third coronary artery: its development and function // Acta Cardiol. – 1988. – Vol. 43(4). – P. 449–457.
31. Murphy, E. S, Rosch J., Rahimtoola S. H. Frequency and significance of coronary arterial dominance in isolated aortic stenosis // Am. J. Cardiol. – 1977. – Vol. 39. – P. 505–509.
32. Nordon, В. G., Rodrigues J. O. F. Variations in the anatomy of the coronary arteries // J. Morphol. Sci. – 2012. – Vol. 29(3). – P. 178–181.
33. Olabu, B. O., Saidi Y. S., Yassanali J., Ogeng’o J. A. Prevalence and Distribution of the third coronary artery in Kenyans // Int. J. Morphol. – 2007. – Vol. 25(4). – P. 851–854.
34. Patel, S. Normal and anomalous anatomy of the coronary arteries // Seminars Roentgenology. – 2008. – Vol. 43(2). – P. 100–112.
35. Pejkovi, I., Krajnc F. A. Anatomical variations of coronary ostia, aortocoronary angles and angles of division of the left coronary artery of the human heart // J. Int. Med. Res. – 2008. – Vol. 36 (5). – P. 914–922.
36. Prajapati, P., Suther K., Patil D., Bhatt C., Patil V. Variation in ostium of coronary arteries // Nat. J. Med. Res. – 2013. – Vol. 3(2). – P. 134–136. 17.09.2014.
37. Reig, J., Petit M. Main trunk of the left coronary artery: Anatomic study of the parameters of clinical interest // Clin Anat. – 2004. – Vol. 17 (1). – P. 6–13.
38. Roy, S., Gupta A., Nanrah B. K., Verma M., Saha R. Morphometric Study of Left Coronary Artery Trunk in Adult Human Cadavers: A Study on the Eastern Region Population // J Clin Diagn Res. – 2014. – Vol. 8(2). – P. 7–9.
39. Saremi, F., Abolhoda A., Ashikyan O., Milliken J. C., Narula J., Gurudevan S. V., [et al.] Arterial supply to sinuatrial and atrioventricular nodes: imaging with multidetector CT // Radiology. – 2008. – Vol. 246(1). – P. 99–107.
40. Singh, R. An anomalous configuration of coronary artery: a cadaveric study // Case Rep. Cardiology. 2013. Article ID 97063, 4 p. doi.: 10.1155/2013/397063.
41. Lüdinghausen, M. V. The Clinical Anatomy of Coronary Arteries. – Berlin [etc.]: Springer, 2003. – Vol. 167. Advances in anatomy, embryology, and cell biology. – P. 29–32.
42. Olabu, B. O., Saidi H. S., Hassanali J., Ogengo’O J. A. Prevalence and distribution of the Third Coronary Artery in Kenyans // Int. J. Morphol. – 2007. – Vol. 25(4). – P. 851–854.
43. Topaz, O., Disciascio G., Cowley M. J., Soffer A., Lanter P., Goudrean E. [et al.] Absent left main coronary artery angiographic fndings in 83 patients with separate ostia of the left descending and circumfex arteries at the left aortic sinus // Am Heart J. – 1991. – Vol. 122. – P. 447–452.
44. Trivellato, M., Angelini P., Leachman R. D. Variations in coronary artery anatomy: Normal versus abnormal // Cardiovascular Diseases, Bulletin of the Texas Heart Institute. – 1980. – Vol. 7(4). – P. 357–370.
45. Taylor, A. M., Thorne S. A. Coronary artery imaging in grown up congenital heart disease – complementary role of megnetic resonance and x-ray coronary angiography // Circulation. – 2000. – Vol. 101(14). – P. 1670–1678.
46. Van Geuns, R. J., Wielopolski P. A., Rensing B. J. [et al.] Magnetic resonance imaging of the coronary arteries: anatomy of the coronary arteries and viens in three-dimensional imaging// Cor. Artery Dis. – 1999. – Vol. 10. – P. 261–267.
47. Vasheghani-Farahani, A., Kassaian S. E., Yaminisharif A., Davoodi G., Salarifar M., Amirzadegan A. [et al.] The association between coronary arterial dominancy and extent of coronary artery disease in angiography and paraclinical studies // Clin Anat. – 2008. – Vol. 21(6). – P. 519–523.
48. Veltman, C. E., de Graaf F. R., Schuijf J. D., van Werkhoven J. M., Jukema J. W., Kaufmann P. A. [et al.] Prognostic value of coronary vessel dominance in relation to significant coronary artery determined with non-invasive computed tomography coronary angiography // Eur Heart J. – 2012. – Vol. 33 (11). – P. 1367–1377. doi: 10.1093/ eurheartj/ehs034.
49. Von Ludinghausen, M., Ochmaci, N. Right superior septal artery with «normal» right coronary and ectopic «early» aortic origin: a contribution to the vascular supply of the interventricular septum of the human heart // Clin Anat. – 2001. – Vol. 14 (5). – P. 312–319.
Существуют определенные несогласованности в номенклатурах, которые используются клиницистами и анатомами для обозначения ветвей венечных сосудов. Например, в руководствах по анатомии используется термин «венечные артерии», а в публикациях по хирургическому лечению ишемической болезни сердца – «коронарные артерии». Кроме того, практикующими кардиологами очень часто используются аббревиатуры английских названий артерий и их ветвей. Это обстоятельство, порою, затрудняет восприятие научных публикаций по актуальным вопросам кардиологии, особенно молодыми врачами, изучавшими морфологию венечных сосудов, используя классические учебники по анатомии. В этой связи, цель настоящей публикации – обобщить современные данные о наиболее часто встречающихся вариантах строения сосудов, кровоснабжающих сердце, сопоставив терминологии, которая применяется в анатомии и клинической практике.
Обычно сердце кровоснабжается двумя венечными артериями, устья которых располагаются в середине правого и левого синусов (синусы Вальсальвы) восходящей части аорты, вблизи свободного края полулунной заслонки клапана аорты [1, 4, 11, 41]. При компьютерной томографии правый синус выявляется со стороны грудины, левый направлен назад и влево. Задний (невенечный) синус находится со стороны межпредсердной перегородки. Уровень расположения устья артерий относительно синотубулярного соединения может варьировать в достаточно широком диапазоне (таблица 1).
Индивидуальные особенности уровня локализации устьев венечных артерий, а также их размеры следует учитывать при проведении коронарографии [18]. Сложности в манипулировании кончиком катетера обычно возникают при расположении устья венечной артерии выше створки клапана [17, 45].
Присутствие дополнительного отверстия на стенке восходящей аорты в области правого синуса может быть связано с самостоятельным отхождением ветви артериального конуса. Такой вариант встречается, в зависимости от популяции, с частотой от 7,1% случаев у жителей Германии [49] до 35,1% у жителей Кении [42] и 36,8% жителей Японии [30]. Наличие третьей венечной артерии создает определенные затруднения при вентрикулостомии и других кардиохирургических операциях [46]. Кроме того, этот сосуд в ряде случаев кровоснабжает не только артериальный конус, но также часть левого желудочка. Поэтому возникающие, при его поражении атеросклерозом или при спазме, клинические проявления ишемии миокарда могут неправильно интерпретироваться, как следствие поражения левой венечной артерии [40].
В области левого синуса аорты также может встречаться несколько отверстий, от которых берут начало сосуды, кровоснабжающие сердце. Cavalcani et al. [13] на выборке из 110 сердец взрослых людей в 1,82% случаев обнаружили, что огибающая и передняя межжелудочковая ветви начинаются от восходящей части аорты самостоятельными отверстиями. По данным Danias et al. [15] и Patel [34] самостоятельные отверстия этих двух ветвей обнаруживаются в 0.41–8% случаев. Отсутствие ствола левой венечной артерии обнаружили Topaz and al. [43] у 83 из 20.332 (0,4%) пациентов, которым проводилось ангиографическое исследование сосудов сердца. Авторы отмечают, что знание о существовании подобной аномалии важно для правильной интерпретации результатов коронарографии. Кроме того, при выполнении операций на сердце в условиях искусственного кровообращения в таком случае требуется селективная перфузия этих сосудов.

Рис. 1. Туннелированная артерия: 1 – правая венечная артерия, 2 – ветвь артериального конуса, 3 – передняя межжелудочковая ветвь (левой венечной артерии), 4 – перегородочная межжелудочковая ветвь, 5 – миокардиальный мышечный мостик
Левая венечная артерия (англ. left coronary artery, LCA) обычно начинается от аорты общим стволом, который разделяется на две ветви. Передняя межжелудочковая ветвь (син. левая передняя нисходящая артерия, англ. left anterior descending artery, LAD) по передней межжелудочковой борозде доходит до верхушки сердца. От нее начинаются ветвь артериального конуса, латеральная (диагональная) ветвь (количество варьирует от одной до трех) и перегородочные межжелудочковые (септальные) ветви. Обычно венечные артерии и их главные ветви лежит субэпикардиально. На рис. 1 демонстрируется феномен миокардиального мышечного мостика – сегмент передней межжелудочковой ветви лежит в толще миокарда. Клинически наличие миокардиального мостика часто ассоциировано со стенокардией, инфарктом миокарда, желудочковой тахикардией, а также с внезапной сердечной смертью [3]. Огибающая ветвь (син. левая огибающая артерия, англ. left circumflex artery, LCx) располагается в левой части венечной борозды. От нее берут начало от одной до трех левых краевых ветвей (син. ветвь тупого края, obtuse marginal branch, OMB), предсердные и предсердно-желудочковые ветви, а также задняя ветвь левого желудочка.
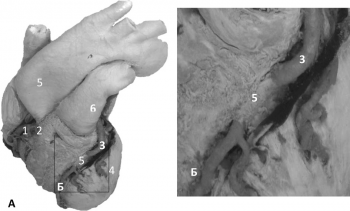
Горячева И. А. [2] выделяет три варианта архитектоники левой венечной артерии: (1) огибающая и передняя межжелудочковая ветвь имеют одинаковый диаметр (62% случаев); (2) преимущественное развитие передней межжелудочковой ветви (8%); (3) преимущественное развитие огибающей ветви (32%). Автор описывает также три варианта следования передней межжелудочковой и огибающей ветви. В первом варианте (62% наблюдений) передняя межжелудочковая артерия «исчезает» (вступает в толщу миокарда) на границе средней и нижней трети передней межжелудочковой борозды; во втором – достигает верхушки сердца (14% случаев); в третьем (24% изученных препаратов) – огибает верхушку сердца и простирается в заднюю межжелудочковую борозду в виде так называемой задней возвратной межжелудочковой артерии (рис. 2). «Короткая» огибающая ветвь, которая достигает только левого края сердца, где продолжается в левую краевую ветвь, встречается в 22% случаях (первый вариант). Почти в половине наблюдений (46%) этот сосуд огибает левый край сердца и разветвляется на его диафрагмальной поверхности на задние желудочные ветви (второй вариант). В 32% случаев огибающая ветвь ложится в заднюю межжелудочковую борозду, направляясь снизу вверх. При этом задняя межжелудочковая ветвь правой венечной артерии отсутствует. Такой вариант характерен для левого типа доминантности кровоснабжения сердца. При правом типе кровоснабжения задняя межжелудочковая ветвь является продолжением правой венечной артерии. При ко-

Рис. 2. Задняя возвратная межжелудочковая ветвь:
1 – передняя межжелудочковая ветвь левой венечной артерии (задняя межжелудочковая ветвь), 2 – правые заднелатеральные ветви, 3 – левая краевая ветвь, 4 – задняя ветвь левого желудочка, 5 – правая венечная артерия, 6 – правая краевая ветвь
1 – передняя межжелудочковая ветвь левой венечной артерии (задняя межжелудочковая ветвь), 2 – правые заднелатеральные ветви, 3 – левая краевая ветвь, 4 – задняя ветвь левого желудочка, 5 – правая венечная артерия, 6 – правая краевая ветвь
доминантном кровоснабжении сердца в формировании задней межжелудочковой артерии принимают участие обе венечные артерии. При определении доминантности учитывается также источник кровоснабжения предсердно-желудочкового узла. Данные о частоте встречаемости типов кровоснабжения сердца, которые основываются на анализе данных коронарографии, представлены в таблице 2. Обращает на себя внимание существенная разница статистических данных относительно частоты встречаемости левого типа кровоснабжения сердца при анатомических и клинических исследованиях. При этом следует заметить, что ангиография дает более достоверные данные относительно архитектоники сосудистого русла миокарда, т. к. позволяет выявлять внутримышечные сосуды и учитывать микроскопические анастомозы ветвей венечных артерий [32].
В литературе имеются данные, указывающие на то, что левый тип доминантности является достоверным прогностическим параметром не фатального инфаркта миокарда и общей смертности [48]. При левом типе доминирования до 90% крови направляется в левую венечную артерию, что создает повышенную нагрузку на интиму сосуда, особенно в местах его разветвления, что является одним из факторов риска развития атеросклероза [22]. При наличии короткого общего ствола левой венечной артерии нагрузки на интиму будут максимальными, поэтому такой вариант анатомического строения венечной артерии рассматривается как дополнительный фактор риска атеросклероза [21]. Коротким считается ствол, который имеет длину менее 5 мм и встречается такой вариант у 7–12% людей. Кроме атеросклероза короткий ствол левой венечной артерии может быть причиной блокады левой ножки пучка Гиса [29]. При коротком стволе левой венечной артерии катетер во время коронарографии может попасть в одну из ветвей, в результате чего не произойдет контрастирование всех сосудов бассейна этой артерии [38].
К вариантам анатомического строения левой венечной артерии относится ее деление не на две, а на три и более ветвей. В углу между передней межжелудочковой и огибающей ветвью нередко начинается добавочная терминальная ветвь (рис. 3). Этот сосуд называют – срединной (промежуточной) ветвью и рассматривается как аналог первой диа-

Рис. 3. Трифуркация левой венечной артерии: 1 – перегородочная межжелудочковая ветвь, 2 – передняя межжелудочковая ветвь, 3 – ствол левой венечной артерии, 4 – аорта, 5 – срединная (промежуточная) ветвь, 6 – огибающая ветвь, 7 –левое ушко (отвернуто)
гональной ветви. Его калибр сопоставим с передней межжелудочковой ветвью, и может даже превосходить диаметр огибающей ветви. Данные о частоте встречаемости данного варианта анатомического строения
Правая венечная артерии (right coronary artery, RCA) располагается в правой части венечной борозды. Ее первой ветвью является ветвь артериального конуса1, второй, в 55–75% наблюдений, артерия синусно-предсердного узла [26, 28, 39]. Вблизи края сердца от нее берут начала от одной до трех правых краевых ветвей (син. ветвь острого края, acute marginal branch, AMB). После перехода на диафрагмальную поверхность сердца от правой венечной артерии начинаются предсердные ветви и задняя межжелудочковая ветвь (син. задняя нисходящая артерия, posterior descending artery, PDA).
Американской ассоциацией кардиологов (American Heart Association, AHA) предложено делить венечные артерии на сегменты. В правой венечной артерии выделяется четыре сегмента: проксимальный (на протяжении от устья сосуда до середины расстояния, который артерия проходит до правого края сердца); средний (от границы с первым сегментом до правого края сердца); дистальный (от правого края сердца до начала задней межжелудочковой ветви) и сегмент, соответствующий самой задней межжелудочковой ветви. В качестве самостоятельного сегмента рассматривается ствол левой венечной артерии (от места ее начала до ветвления на переднюю межжелудочковую и огибающую ветвь). В передней межжелудочковой ветви выделяется пять сегментов: проксимальный (до первой септальной/диагональной ветви); средний (от границы с предыдущим сегментом до второй диагональной ветви, т. е., примерно до середины расстояния от начала сегмента до верхушки

1 Ветвь артериального конуса, которая начинается от дуги аорты самостоятельным стволом, называется третьей венечной артерий (рис. 4).
Рис. 4. Третья венечная артерия (ветвь артериального конуса): 1 – правая венечная артерия, 2 – ветвь артериального конуса, 3 – передняя межжелудочковая ветвь (левой венечной артерии), 4 – латеральная ветвь, 5 – огибающая ветвь (левой венечной артерии),
6 – перегородочные межжелудочковые ветви сердца); дистальный (от границы со средним сегментом до верхушки сердца), а также сегменты, соответствующие первой и второй диагональной артерии. В состав огибающей ветви входят пять сегментов: проксимальный (от бифуркации ствола левой венечной артерии до начала первой артерии тупого края); дистальный (начинается после отхождения первой артерии тупого края); сегменты, соответствующие первой и второй артерии тупого края, а также задней ветви левого желудочка.
Учитывая большое разнообразие вариантов архитектоники венечных сосудов, неоднократно предпринимались попытки определить, какой из вариантов следует принимать за норму. В качестве
«минимальных критериев» нормального строения этих сосудов Trivellato et al. [44] предложили следующие качественные параметры:
– правая венечная артерия лежит в венечной борозде, отделяющей правое предсердие от правого желудочка;
– левая венечная артерия начинается общим стволом, который лежит позади легочного ствола и разделяется на две ветви (переднюю межжелудочковую ветвь и огибающую ветвь2);
– передняя межжелудочковая ветвь расположена в одноименной борозде на грудино-реберной поверхности сердца и от нее начинаются перегородочные межжелудочковые ветви;
– огибающая ветвь проводит в (венечной) борозде между левыми предсердием и желудочком;
– задняя межжелудочковая ветвь начинается от правой или левой венечной артерии, лежит в одноименной борозде на диафрагмальной поверхности сердца и отдает перегородочные межжелудочковые ветви;
– сами венечные артерии и их крупные ветви лежат под эпикардом (экстрамурально).
Качественные и количественные критерии, свидетельствующие о «нормальности» венечных артерий у человека, которые предложены Angelini [5], представлены в таблице 4.
По сравнению с приведенными выше критериями нормального строения венечных артерий, варианты нормы в отношении этих сосудов варьируют в широком диапазоне. Считается, что любой вариант отхождения венечной артерии, ее хода и ветвления,
который встречается более чем у 1% людей сплошной выборки следует признавать нормой [5, 10, 14].
2 Названия сосудов приводятся в соответствии с Международной анатомической терминологией (Л. Л. Колесников, 2003).
В заключение следует отметить, что архитектоника венечных сосудов весьма вариабельная, индивидуальные особенности их анатомического строения выявляются не только на аутопсийном материале, но также in vivo с использованием современных диагностических технологий (селективной коронарографии, спиральной компьютерной томографии и др.). Наличие отдельных анатомических вариантов может рассматриваться как фактор риска возникновения и прогрессирования сосудистой патологии, в частности атеросклероза, с последующей ишемией миокарда.
Литература
1. Бокерия, Л. А., Беришвили, И. И. Хирургическая анатомия венечных артерий. – М.: Изд-во НЦССХ им. А. Н. Бакулева РАМН, 2003. – 297 с.
2. Горячева, И. А. Особенности архитектоники магистральных ветвей правой венечной артерии // Фундаментальная наука и клиническая медицина – человек и его здоровье: мат. XV Юбилейной Всерос. медико-биологической конф. молодых исследователей (с международным участием). – СПб.: Изд-во СПбГУ, 2012. – С. 81.
3. Бокерия, Л. А., Алекян, Б. Г. Тетвадзе, И. В. Ангиографическая диагностика миокардиальных мышечных мостиков // Сердечно-сосудистые заболевания. – 2011. – № 1 (12). – С. 102–109.
4. Целуйко, В. Н., Мищук Н. Е., Киношенко К. Ю. Аномалии строения коронарных артерий (часть 1) // Дiабет i сердце. – 2012. – № 10 (164). – С. 44–51.
5. Agelini, P. Congenital Heart Disease for the Adult Cardiologist Coronary Artery Anomalies An Entity in Search of an Identity // Circulation. – 2007. – Vol. 115 (10). – P. 1296–1305.
6. Ajayi, N. O., Lazarus L., Vanker E. A, Satyapal K. S. The prevalence and clinical importance of an «additional» terminal branch of the left coronary artery // Folia Morphol (Warsz). – 2013. – Vol. 72(2). – P. 128–131.
7. Angelini, P., Villason S., Chan A. V., Diez J. G. Normal and anomalous coronary arteries in humans // Coronary Artery Anomalies: A Comprehensive Approach / ed. by P. Angelini. – Philadelphia: Lippincott Williams & Wilkins, 1999. – P. 27–150.
8. Ballesteros, L. E., Ramirez L. M. Morphological expression of the left coronary artery: a direct anatomical study // Folia Morphol. – 2008. – Vol. 67(2). – P. 135–142.
9. Baptista, C. A., DiDio L. J., Prates J. C. Types of division of the left coronary artery and the ramus diagonalis of the human heart // Jpn Heart J. – 1991. – Vol. 32(3). – P. 323–335.
10. Becker, A. E., Anderson R. H. Coronary artery anomalies // Pathology of Congenital Heart Disease / eds.: A. E. Becker, R. H. Anderson. – London: Butterworths, 1981. – P. 369–378.
11. Berdajs, D., Turina M. Operative anatomy of the heart. Berlin [etc.]: Springer, 2011. P. 164–168.
12. Cademartiri, F., La. GL., Malago R., Alberghina F., Meijboom W. B., Pugliese F. [et al.] Prevalence of anatomical variants and coronary anomalies in 543 consecutive patients studied with 64-slice CT coronary angiography // Eur Radiol. – 2008. – Vol. 18 (4). – P. 781–791.
13. Cavalcanti, J. S., de Lucena Oliveira M., Paise Melo A. V., Jr. Balaban G., de Andrade Oliveira C. L., de Lucena Oliveira E. Anatomic variations of the coronary arteries // Arq. Bras. Cardiol. – 1995. – Vol. 65(6). – P. 489–492.
14. Click, R. L., Holmes Jr., Vlietstra R. E., Kosinski A. S., Kronmal R. A. Anomalous coronary arteries: location, degree of atherosclerosis and effect on survival – a report from the coronary artery surgery study // J. Am Coll. Cardiol. – 1989. – Vol. 13(3). – P. 531–537.
15. Danias, P. G., Stuber M., McConnell M. V., Manning W. J. The diagnosis of congenital coronary anomalies with magnetic resonance imaging // Coronary Artery Disease. – 2001. – Vol. 12(8). – P. 621–626.
16. Das Hirak Termination of left coronary in the population of Assam // Nat. J. Basic Med. Scien. – 2014. – Vol. 4(3). – P. 145–148.
17. Dombe, D. D., Anitha T., Giri P. A., Dombe S. D., Ambiye M. V. Clinically relevant morphometric analysis of left coronary artery // Int. J. Biol. Med. Res. – 2012. – Vol. 3(1). – P. 1327–1330.
18. Engel, H. J., Torres C. Major variations in anatomical origin of the coronary arteries-angiographic observations in 4,250 patients without associated congenital heart disease // Cathet. Cardiovasc Diagn. – 1975. – Vol. 116(5). – P. 157–169.
19. Eren, S., Bayram E., Fil F., Koplay M., Sirvanci M., Duran C. [et al.] An investigation of the association between coronary artery dominance and coronary artery variations with coronary arterial disease by multidetector computed tomographic coronary angiography // J. Comput Assist Tomogr. – 2008. – Vol. 32. – P. 929–933.
20. Fazliogullari, Z., Karabulut A. K., Unver Dogan N., Uysal I. I. Coronary artery variations and median artery in Turkish cadaver hearts // Singapore Med. J. – 2010. – Vol. 51 (10). – P. 775–80.
21. Gazetopoulos, N., Ioannidis P. J., Marselos A., Kelekis D., Lolas C., Avgoustakis D., Tountas C. Length of main left coronary artery in relation to atherosclerosis of its branches. A coronary arteriographic study // Br Heart J. – 1976. – Vol. 38 (2). – P. 180–185.
22. Ghaffari, S., Kazemi B., Dadashzadeh J., Sepehri B. The Relation between Left Coronary Dominancy and AtheroscleroticInvolvement of Left Anterior Descending Artery // Origin. J Cardiovasc Thorac Res. – 2013. – Vol. 5(1). – P. 1–4.
23. Goldberg, A., Southern D. A, Galbraith P. D., Traboulsi M., Knudtson, M. L., Ghali W. A. Coronary dominance and prognosis of patients with acute coronary syndrome // Am Heart J. – 2007. – Vol. 154 (6). – P. 1116–1122.
24. Hutchins, G. M, Nazarian I. H., Bulkley B. H. Association of left dominant coronary arterial system with congenital bicuspid aortic valve // Am J Cardiol. – 1978. – Vol. 42. (1). – P. 57–59.
25. Kalpana, R. A. Study On Principal Branches of Coronary Arteries In Humans // J. Anat. Soc. India. – 2003. – Vol. 52(2). – P. 137–140.
26. Kini, S., Bis K., Weaver L. Normal and Variant Coronary Arterial and Venous // Anatomy on HighResolution CT Angiography. AJR. – 2007. – Vol. 188. – P. 1665–1674.
27. Knaapen, M., Koch A. H., Koch C., Koch K. T., Li X., van Rooij P. C., Tijssen J. G., Peters R. J., van der Wal A. C., Damman P., de Winter R. J. Prevalence of left and balanced coronary arterial dominance decreases with increasing age of patients at autopsy. A postmortem coronary angiograms study // Cardiovasc Pathol. – 2013. – Vol. 22(1). – P. 49–53.
28. Krupa, U. The sinuatrial nodal artery in the human heart // Folia Morphol (Warsz). – 1993. – Vol. 52(1). – P. 29–37.
29. Lewis, C. M., Dagenais G. R., Friesinger G. C., Ross R. S. Coronary arteriographic appearances in Patients with Left Bundle-Branch Block // Circulation. – 1970. – Vol. 41(2). – P. 299–307.
30. Miyazaki, K. Third coronary artery: its development and function // Acta Cardiol. – 1988. – Vol. 43(4). – P. 449–457.
31. Murphy, E. S, Rosch J., Rahimtoola S. H. Frequency and significance of coronary arterial dominance in isolated aortic stenosis // Am. J. Cardiol. – 1977. – Vol. 39. – P. 505–509.
32. Nordon, В. G., Rodrigues J. O. F. Variations in the anatomy of the coronary arteries // J. Morphol. Sci. – 2012. – Vol. 29(3). – P. 178–181.
33. Olabu, B. O., Saidi Y. S., Yassanali J., Ogeng’o J. A. Prevalence and Distribution of the third coronary artery in Kenyans // Int. J. Morphol. – 2007. – Vol. 25(4). – P. 851–854.
34. Patel, S. Normal and anomalous anatomy of the coronary arteries // Seminars Roentgenology. – 2008. – Vol. 43(2). – P. 100–112.
35. Pejkovi, I., Krajnc F. A. Anatomical variations of coronary ostia, aortocoronary angles and angles of division of the left coronary artery of the human heart // J. Int. Med. Res. – 2008. – Vol. 36 (5). – P. 914–922.
36. Prajapati, P., Suther K., Patil D., Bhatt C., Patil V. Variation in ostium of coronary arteries // Nat. J. Med. Res. – 2013. – Vol. 3(2). – P. 134–136. 17.09.2014.
37. Reig, J., Petit M. Main trunk of the left coronary artery: Anatomic study of the parameters of clinical interest // Clin Anat. – 2004. – Vol. 17 (1). – P. 6–13.
38. Roy, S., Gupta A., Nanrah B. K., Verma M., Saha R. Morphometric Study of Left Coronary Artery Trunk in Adult Human Cadavers: A Study on the Eastern Region Population // J Clin Diagn Res. – 2014. – Vol. 8(2). – P. 7–9.
39. Saremi, F., Abolhoda A., Ashikyan O., Milliken J. C., Narula J., Gurudevan S. V., [et al.] Arterial supply to sinuatrial and atrioventricular nodes: imaging with multidetector CT // Radiology. – 2008. – Vol. 246(1). – P. 99–107.
40. Singh, R. An anomalous configuration of coronary artery: a cadaveric study // Case Rep. Cardiology. 2013. Article ID 97063, 4 p. doi.: 10.1155/2013/397063.
41. Lüdinghausen, M. V. The Clinical Anatomy of Coronary Arteries. – Berlin [etc.]: Springer, 2003. – Vol. 167. Advances in anatomy, embryology, and cell biology. – P. 29–32.
42. Olabu, B. O., Saidi H. S., Hassanali J., Ogengo’O J. A. Prevalence and distribution of the Third Coronary Artery in Kenyans // Int. J. Morphol. – 2007. – Vol. 25(4). – P. 851–854.
43. Topaz, O., Disciascio G., Cowley M. J., Soffer A., Lanter P., Goudrean E. [et al.] Absent left main coronary artery angiographic fndings in 83 patients with separate ostia of the left descending and circumfex arteries at the left aortic sinus // Am Heart J. – 1991. – Vol. 122. – P. 447–452.
44. Trivellato, M., Angelini P., Leachman R. D. Variations in coronary artery anatomy: Normal versus abnormal // Cardiovascular Diseases, Bulletin of the Texas Heart Institute. – 1980. – Vol. 7(4). – P. 357–370.
45. Taylor, A. M., Thorne S. A. Coronary artery imaging in grown up congenital heart disease – complementary role of megnetic resonance and x-ray coronary angiography // Circulation. – 2000. – Vol. 101(14). – P. 1670–1678.
46. Van Geuns, R. J., Wielopolski P. A., Rensing B. J. [et al.] Magnetic resonance imaging of the coronary arteries: anatomy of the coronary arteries and viens in three-dimensional imaging// Cor. Artery Dis. – 1999. – Vol. 10. – P. 261–267.
47. Vasheghani-Farahani, A., Kassaian S. E., Yaminisharif A., Davoodi G., Salarifar M., Amirzadegan A. [et al.] The association between coronary arterial dominancy and extent of coronary artery disease in angiography and paraclinical studies // Clin Anat. – 2008. – Vol. 21(6). – P. 519–523.
48. Veltman, C. E., de Graaf F. R., Schuijf J. D., van Werkhoven J. M., Jukema J. W., Kaufmann P. A. [et al.] Prognostic value of coronary vessel dominance in relation to significant coronary artery determined with non-invasive computed tomography coronary angiography // Eur Heart J. – 2012. – Vol. 33 (11). – P. 1367–1377. doi: 10.1093/ eurheartj/ehs034.
49. Von Ludinghausen, M., Ochmaci, N. Right superior septal artery with «normal» right coronary and ectopic «early» aortic origin: a contribution to the vascular supply of the interventricular septum of the human heart // Clin Anat. – 2001. – Vol. 14 (5). – P. 312–319.
Источник: C. Л. Кабак, Н. В. Синельникова, Н. В. Журавлёва
Авторское право на материал
Копирование материалов допускается только с указанием активной ссылки на статью!
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Похожие статьи