Алюминий прочно вошёл в нашу жизнь: каждому с детства знакомы алюминиевая фольга, посуда, проволока.
Изделия из алюминия.
А ведь когда-то изделия из алюминия считались роскошью. Например, в 1852 г. килограмм металла стоил 1200 долларов — дороже золота! Почему же со временем цена на алюминий так упала? Ответ прост: алюминий широко распространён в земной коре (8%), уступая в этом лишь кислороду и кремнию. «Достаточно указать на то, что он входит в состав глины, чтоб ясно было всеобщее распространение алюминия в коре земной. «...Алюминий, или металл квасцов (alumen), потому и называется иначе глинием, что находится в глине», — писал Д. И. Менделеев. Белая глина, или каолин Аl2О3•2SiO2•2Н2О, рождается при выветривании алюмосиликатов, например полевого шпата ортоклаза К2О•Аl2О3•6SiO2, слюды К2О•3Аl2О3•6SiO2•2Н2О, нефелина (Na, К)2О•Аl2О3•2SiO2. Одновременно с глиной при этом образуются кварцевый песок SiO2, бокситы Аl2О3•2Н2О и корунд Аl2О3. Окрашенные кристаллы корунда — это широко известные драгоценные камни рубин и сапфир. Наименование самого металла происходит от латинского названия квасцов (alumen — «горькая соль») KAl(SO4)2•12Н2О. Издревле квасцы использовались в качестве протравы
при крашении тканей; об этом упоминает ещё греческий историк Геродот. В 1754 г. немецкий химик Андреас Cuгизмунд Маргграф, действуя на раствор квасцов щёлочью, получил осадок гидратированного оксида алюминия, названный им квасцовой землёй. Позднее эту землю стали именовать алюминон (alumina) или глинозёмом. Выделить из глинозёма металл с помощью электролиза безуспешно пытался Г. Дэви: вещество практически не растворялось в воде. Удача улыбнулась датскому физику Хансу Кристиану Эрстеду (1777—1851): в 1825 г. путём нагревания безводного хлорида алюминия с амальгамой калия он впервые получил алюминий. Хлорид алюминия учёный синтезировал, пропуская хлор над нагретой смесью корунда с сажей: Аl2О3+3С+3Сl2=2АlСl3+3СО.
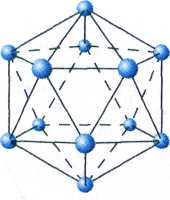
Икосаэдр В12 — фрагмент кристаллической структуры бора.
Если смешать горячие концентрированные растворы сульфатов алюминия и калия, а полученный раствор охладить, то из него начнут кристаллизоваться квасцы — двойной сульфат калия и алюминия 2KAl(SO4)2•12Н2О. С ростом температуры их растворимость в воде существенно возрастает (5,9 г на 100 г воды при 20 °С, 109 г — при 90 °С в пересчёте на безводную соль). При хранении на воздухе квасцы выветриваются. При температуре 92,5 °С квасцы плавятся в своей кристаллизационной воде, а при нагревании до 120 °С обезвоживаются, переходя в жжёные квасцы, которые разлагаются лишь при температуре выше 700 °С. Молекулы воды, входящие в состав квасцов, связаны химической связью с ионами калия и алюминия, поэтому формулу квасцов правильнее записывать в виде комплексной соли [K(H2O)6][Al(H2O)6](SO4)2.
Если в пробирку из термостойкого стекла поместить несколько миллилитров брома и аккуратно опустить в него кусочек алюминиевой фольги, то через некоторое время (необходимое для того, чтобы бром проник через оксидную плёнку) начнётся бурная реакция. От выделяющегося тепла алюминий плавится и в виде маленького огненного шарика катается по поверхности брома (плотность жидкого алюминия меньше плотности брома), быстро уменьшаясь в размерах. Пробирка наполняется парами брома и белым дымом, состоящим из мельчайших кристаллов бромида алюминия: 2Al+3Вr2=2AlВr3.
Два года спустя данный метод усовершенствовал немецкий химик Фридрих Вёлер, заменив амальгаму калия на чистый калий: АlСl3+3К=3КСl+Аl. Этого исследователя обычно и считают первооткрывателем алюминия, так как именно он исследовал свойства нового металла. Способ, разработанный Вёлером, лёг в основу промышленного производства алюминия, с той лишь разницей, что вместо довольно опасного и дорогого калия стали использовать более дешёвый натрий (процесс, предложенный французским химиком Анри Сент
Клер Девилем в 1854 г.). Это позволило к 1856 г. снизить цену на металл до 75 долларов за килограмм.
В 1855 г. большой слиток «серебра из глины» (так назвали алюминий) был представлен на Всемирной выставке в Париже. Новое падение цены на этот металл связано с внедрением электролитического метода, разработанного французским инженером Полем Эру (1863—1914) и американским инженером Чарлзом Мартином Холлом в 1886 г. Согласно этому методу, используемому и в настоящее время, расплаву подвергают не сам Al2О3 (tпл=2045 °С), а его раствор в расплавленном криолите Na3AlF6. Процесс проводят в электрических печах при температуре около 960 °С. В промышленных электролизёрах используют электроды, сделанные из графита.
Кислород, выделяющийся на аноде в процессе электролиза, вступает в реакцию с графитом (2С+О2=2СО). Расплавленный металл, собирающийся на дне электролизёра, периодически выпускают.
Чистый алюминий — лёгкий серебристо-белый металл (tпл=660 °С, tкип=2467 °С), характеризующийся высокой пластичностью, тепло- и электропроводностью. При 100—150 °С алюминий настолько пластичен, что из него удаётся получить фольгу толщиной менее 0,01 мм. Алюминиевая фольга применяется в производстве конденсаторов и как обёрточный материал. Алюминиевые провода намного легче медных, что компенсирует меньшую электропроводность алюминия. Однако под действием тока места соединения таких проводов сильно нагреваются, провода подплавляются, из-за этого нередко случаются короткие замыкания и пожары.
Сплавы на основе алюминия (например, дуралюмин — 94% Аl, 4% Cu, 0,5% Mg, 0,5% Mn, 0,5% Fe и 0,5% Si) сочетают лёгкость с высокой прочностью. Они используются в машиностроении, авиационной промышленности.
Помимо лёгкости алюминий имеет ещё одно преимущество перед железом — он не ржавеет. Это объясняется тем, что алюминий надёжно защищён с поверхности тончайшей плёнкой оксида, которая предохраняет металл от дальнейшего окисления.
В прочности такой плёнки нетрудно убедиться на опыте. Внесите в пламя кусок алюминиевой фольги, и вскоре он раскалится докрасна. Вы увидите, что металл плавится, но при этом не стекает, а удерживается тончайшей, едва заметной плёнкой оксида, покрывающей его со всех сторон.
Мелко раздробленный металл — алюминиевая пудра (она служит основой для серебряной краски) -при накаливании на воздухе сгорает ослепительно белым пламенем, выбрасывая целый сноп искр.
Алюминий — химически активный металл. Он взаимодействует с галогенами (образуя тригалогениды), при нагревании — с серой (образуя Al2S3), а в раскалённом состоянии — с азотом и углеродом.
Алюминий энергично реагирует с разбавленными растворами кислот, однако инертен по отношению к концентрированным кислотам-окислителям — серной и азотной. Алюминий способен растворяться также в растворах щелочей: 2Аl+2NaOH+6Н2О= 2Na[Al(OH)4]+3H2.
Из соединений алюминия наиболее широко применяются оксид, хлорид и сульфат. Кристаллический оксид (корунд) — основа искусственных рубинов и сапфиров; из него делают подшипники, лазеры. Безводный хлорид служит катализатором в органическом синтезе. Сульфат применяют
для очистки воды:
Al2(SO4)3+3Са(НСО3)2=3CaSO4¯+2Аl(ОН)3¯+6СО2.
Оседающие хлопья Аl(ОН)3 увлекают с собой из воды различные примеси. Двойной сульфат калия и алюминия (квасцы), как и прежде, используется для протравы при окраске тканей, а также для дубления кож, проклейки бумаги, в медицине (вяжущее средство). Особо стоит отметить применение алюминия в металлотермии (алюмотермии) — процессе восстановления металлов из их оксидов.





Похожие статьи