Свойства ферментов как биокатализаторов:
1) Специфичность (избирательность) действия. Выделяют такие виды ее:
а) абсолютная специфичность – фермент катализирует превращение только одного субстрата (один фермент – один субстрат). Пример – уреаза, аргиназа, сахараза, лактаза и др.
б) стереоструктурная – фермент катализирует превращение определенного стереоизомера (лактатдегидрогеназа превращает только Lлактат)
в) относительная – фермент катализирует превращение группы веществ с одним типом хи мической связи (один фермент – одна связь). Пример пептидазы, эстеразы, гликозидазы.
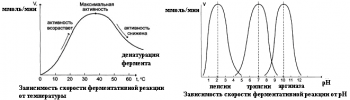
2) Зависимость скорости ферментативной реакции от температуры. Ферментативные реак ции, как и все химические реакции, ускоряются при повышении температуры (в 24 раза на каждые 10оС). Однако скорость ферментативной реакции имеет свой температурныйопти мум, превышение которого приводит к понижению активности ферментов изза тепловой денатурации их молекул. Для большинства ферментативных реакций температурный опти мум 3840оС, а при 5060оС и выше скорость ферментативных реакций сильно уменьшается изза разрушения молекул фермента (искл. миокиназа не инактивируется даже при 100 оС). Зависимость активности ферментов от температуры называется термолабильностью. Фер менты лучше сохраняются при низких температурах – их активность снижается, но денату рации не происходит. Это свойство используется в медицине для производства препаратов ферментов. При некоторых операциях необходимо снизить скорость обмена веществ. Тогда используют охлаждение органов (например, при пересадке почек, сердца и др. органов).
3) ЗависимостьферментативнойактивностиотрНсреды. Каждый фермент имеет свой рН– оптимум значение рН, при котором его активность максимальна. Фермент, как и любой бе лок, имеет в своей структуре ионогенные группы (например, карбоксильные группы или аминогруппы в боковых цепях), а от концентрация ионов водорода зависит их диссоциация и соотношение между положительно и отрицательно заряженными группами. Соотношение между этими группами определяет и пространственное строение молекулы фермента (его конформацию), а следовательно, и его активность. Большинство ферментов наиболее актив ны при рН=68. Исключения пепсин (рНопт=1,52), аргиназа (рНопт=1011).
4) Ферменты ускоряют как прямую так и обратную реакции (например, лактатдегидрогеназа)
5) Активность ферментов может изменяться под влиянием различных веществ, которые мо гут повышать (активаторы) или снижать (ингибиторы) скорость катализируемой реакции.
6) Ферменты в отличие от небиологических катализаторов проявляют более высокую актив ность и проявляют свою способность ускорять реакции в очень маленьких концентрациях (например, одна молекула карбангидразы способна расщепить 36 млн. молекул Н2СO3).
7) Ферменты, как и небиологические катализаторы, катализируют только те реакции, которые подчиняются II закону термодинамики и являются энергетически возможными. Фермен ты не входят в состав конечных продуктов реакции, не влияют на константу равновесия ре акции, а только увеличивают скорость ее достижения.
1) Специфичность (избирательность) действия. Выделяют такие виды ее:
а) абсолютная специфичность – фермент катализирует превращение только одного субстрата (один фермент – один субстрат). Пример – уреаза, аргиназа, сахараза, лактаза и др.
б) стереоструктурная – фермент катализирует превращение определенного стереоизомера (лактатдегидрогеназа превращает только Lлактат)
в) относительная – фермент катализирует превращение группы веществ с одним типом хи мической связи (один фермент – одна связь). Пример пептидазы, эстеразы, гликозидазы.
2) Зависимость скорости ферментативной реакции от температуры. Ферментативные реак ции, как и все химические реакции, ускоряются при повышении температуры (в 24 раза на каждые 10оС). Однако скорость ферментативной реакции имеет свой температурныйопти мум, превышение которого приводит к понижению активности ферментов изза тепловой денатурации их молекул. Для большинства ферментативных реакций температурный опти мум 3840оС, а при 5060оС и выше скорость ферментативных реакций сильно уменьшается изза разрушения молекул фермента (искл. миокиназа не инактивируется даже при 100 оС). Зависимость активности ферментов от температуры называется термолабильностью. Фер менты лучше сохраняются при низких температурах – их активность снижается, но денату рации не происходит. Это свойство используется в медицине для производства препаратов ферментов. При некоторых операциях необходимо снизить скорость обмена веществ. Тогда используют охлаждение органов (например, при пересадке почек, сердца и др. органов).
3) ЗависимостьферментативнойактивностиотрНсреды. Каждый фермент имеет свой рН– оптимум значение рН, при котором его активность максимальна. Фермент, как и любой бе лок, имеет в своей структуре ионогенные группы (например, карбоксильные группы или аминогруппы в боковых цепях), а от концентрация ионов водорода зависит их диссоциация и соотношение между положительно и отрицательно заряженными группами. Соотношение между этими группами определяет и пространственное строение молекулы фермента (его конформацию), а следовательно, и его активность. Большинство ферментов наиболее актив ны при рН=68. Исключения пепсин (рНопт=1,52), аргиназа (рНопт=1011).
4) Ферменты ускоряют как прямую так и обратную реакции (например, лактатдегидрогеназа)
5) Активность ферментов может изменяться под влиянием различных веществ, которые мо гут повышать (активаторы) или снижать (ингибиторы) скорость катализируемой реакции.
6) Ферменты в отличие от небиологических катализаторов проявляют более высокую актив ность и проявляют свою способность ускорять реакции в очень маленьких концентрациях (например, одна молекула карбангидразы способна расщепить 36 млн. молекул Н2СO3).
7) Ферменты, как и небиологические катализаторы, катализируют только те реакции, которые подчиняются II закону термодинамики и являются энергетически возможными. Фермен ты не входят в состав конечных продуктов реакции, не влияют на константу равновесия ре акции, а только увеличивают скорость ее достижения.
Авторское право на материал
Копирование материалов допускается только с указанием активной ссылки на статью!
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
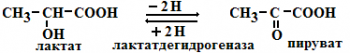
Похожие статьи