Сера принадлежит к числу веществ, известных человечеству испокон веков. Ещё древние греки и римляне нашли ей разнообразное практическое применение. Куски самородной серы использовались для совершения обряда изгнания злых духов. Так, по легенде, Одиссей, возвратившись в родной дом после долгих странствий, первым делом велел окурить его серой. Много упоминаний об этом веществе встречается в Библии.
В Средние века сера занимала важное место в арсенале алхимиков. Как они считали, все металлы состоят из ртути и серы: чем меньше серы, тем благороднее металл. Практический интерес к этому веществу в Европе возрос в XIII—XIV вв., после появления пороха и огнестрельного оружия.
Добыча серы. Гравюра из книги Г. Агриколы «О горном деле и металлургии». Издание 1557 г. Руду, содержащую серу, нагревают в широких глиняных горшках А с длинными клювообразными носиками, опущенными в специальные отверстия в приёмнике B, закрытом крышкой C. Расплавленную серу черпают из приёмника ковшами и разливают в формы.
Ромбическая сера.

Из расплава кристаллизуется моноклинная модификация серы.

Пластическая сера эластична, как резина.
Главным поставщиком серы была Италия.
В наши дни сера используется как сырьё для производства серной кислоты, при вулканизации каучука, в органическом синтезе. Порошок серы применяют в медицине в качестве наружного дезинфицирующего средства.
Сера образует несколько аллотропных модификаций. Устойчивая при комнатной температуре ромбическая серя представляет собой жёлтый порошок, нерастворимый в воде. При кристаллизации из хлороформа СНCl3 или из сероуглерода CS2 она выделяется в виде прозрачных кристаллов октаэдрической формы. Ромбическая сера состоит из циклических молекул S8, имеющих форму короны. При 113 °С она плавится, превращаясь в жёлтую легкоподвижную жидкость. При дальнейшем нагревании расплав загустевает, так как в нём образуются длинные полимерные цепочки. А если нагреть серу до 445 °С, она закипает. Выливая кипящую серу тонкой струйкой в холодную воду, можно получить пластическую серу — резиноподобную модификацию, состоящую из поли-
мерных цепочек. При медленном охлаждении расплава образуются тёмно-жёлтые игольчатые кристаллы моноклинной серы (tпл=119°С). Подобно ромбической сере, эта модификация состоит из молекул S8. При комнатной температуре пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в порошок ромбической серы.
При нагревании сера реагирует со многими металлами (железом, алюминием, ртутью) и неметаллами (кислородом, галогенами, водородом). «Природа серы огненная, горючая... [Сера] нацело сгорает, улетучиваясь в дым», — записано в одном алхимическом трактате. Действительно, при горении серы на воздухе или в кислороде образуется оксид серы(IV), или сернистый газ, SO2, содержащий примесь (около 3% по объёму) высшего оксида серы, или серного ангидрида, SO3,. Сернистый газ SO2 — бесцветный газ с удушливым резким запахом. При растворении его в воде (при 0 °С 1 объём воды растворяет более 70 объёмов SO2) образуется сернистая кислота H2SO3, которая известна только в растворах. Однако её соли — сульфиты (например, Na2SO3) и гидросульфиты (NaHSO3) — легко могут быть выделены в твёрдом виде.
В лабораторных условиях для получения SO, действуют на твёрдый сульфит натрия концентрированной серной кислотой: Na2SO3+2H2SO4=2NaHSO4+SO2+H2O.

Горение серы в кислороде.
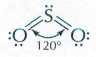
Строение молекулы SO2
Строение серы:
1 — ромбической и моноклинной, S8;
2 — пластической, Sn
*Вулканизация — процесс превращения каучука в резину путём образования сульфидных «мостиков» между отдельными молекулами полимера. Получающийся сшитый» полимер обладает пространственной структурой и характеризуется повышенной механической прочностью.
В промышленности SO2 получают при обжиге сульфидных руд, например пирита: 4FeS2+11O2=2Fe2O3+8SO2, или при сжигании серы. Сернистый газ является полупродуктом в производстве серной кислоты. Его используют также (вместе с гидросульфитами натрия NaHSO3 и кальция Ca(HSO3)2) для выделения целлюлозы из древесины. Этим газом окуривают деревья и кустарники, чтобы уничтожать вредителей сельского хозяйства.
Серный ангидрид SO3 при комнатной температуре представляет собой бесцветную легко летучую жидкость (tкип=45 °С), которая со временем переходит в асбестовидную модификацию, состоящую из блестящих шелковистых кристаллов. Волокна серного ангидрида устойчивы лишь в запаянном сосуде. Поглощая влагу воздуха, они превращаются в густую бесцветную жидкость — олеум (от лат. oleum — «масло»). Хотя формально олеум можно рассматривать как раствор SO3 в H2SO4, на самом деле он представляет собой смесь различных пиросерных кислот: H2S2O7, H2S3O10 и т. д. С водой SO3 взаимодействует очень энергично: при этом выделяется так много теплоты, что образующиеся мельчайшие капельки серной кислоты создают туман. Работать с этим веществом нужно крайне осторожно.
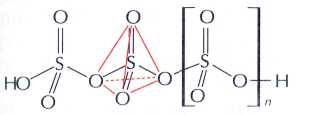
Строение асбестовидной модификации серного ангидрида.
Асбестовидная модификация SO3.
Сернистый газ проявляет сильное отбеливающее действие: красная роза, опушенная в колбу с SO2, теряет свой цвет.
Серная кислота H2SO4 — тяжёлая маслянистая бесцветная жидкость, смешивающаяся с водой в любых пропорциях. При 10 °С она затвердевает, образуя прозрачную стекловидную массу. При нагревании 100-процентная серная кислота легко теряет серный ангидрид до тех пор, пока её концентрация не составит 98 %. Именно такую кислоту обычно и используют в лабораториях (концентрированная серная кислота, tкип=338 °С).
Помните, что вливать кислоту в воду нужно тонкой струйкой при постоянном перемешивании. Ни в коем случае нельзя лить воду в кислоту! Из-за сильного разогрева вода закипит, и горячие брызги раствора серной кислоты могут попасть в лицо.
Разбавленная серная кислота проявляет все свойства неорганических кислот: взаимодействует с основными оксидами, основаниями и активными металлами с выделением водорода. H2SO4 относится к сильным кислотам, в водном растворе кислоты её молекул
Строение (SO3)3.
*Асбестовидный SO3 (tпл=32 °С) представляет собой кристаллическую полисерную кислоту, состоящую из длинных цепочек HO—(S(O)2—O—)n—OH. Однако фактически это чистый серный ангидрид, так как длина такой цепи (n) составляет 105 т. е. два атома водорода приходятся на 105 атомов серы. Жидкая при комнатной температуре модификация серного ангидрида (tпл=17 °С), состоит из циклических молекул (SO3)3.
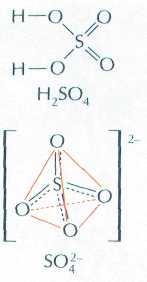
не существует: они распадаются на ионы водорода и гидросульфат-ионы (HSO-4), которые диссоциируют только при сильном разбавлении.
Концентрированная серная кислота — сильный окислитель. Она реагирует как с активными металлами, так и со стоящими в ряду напряжений правее водорода — медью, серебром, ртутью. Металл окисляется, а серная кислота восстанавливается до серы, сероводорода (при реакции с цинком, магнием) или до сернистого газа, как это происходит при взаимодействии с неактивным металлом — медью:
Cu+2H2SO4=CuSO4+SO2+2Н2О.
Крепкая (50—70-процентная) серная кислота легко окисляет железо:
2Fe+6H2SO4=Fe2(SO4)3+3SO2+6H2O.
В то же время на холоде олеум не реагирует с железом и алюминием.
Концентрированная серная кислота способна обугливать многие органические вещества (сахар, бумагу, вату). При случайном попадании H2SO4 на кожу необходимо тут же смыть её струёй воды, а затем обработать место ожога слабым раствором соды.
Упоминания о серной кислоте впервые встречаются у арабских и европейских алхимиков. Её получали, прокаливая на воздухе железный купорос (витриол, или гидратированный сульфат железа(II), FeSO4•7Н2О):
2FeSO4=Fe2O3+SO3+SO2 либо смесь серы с селитрой: 6KNO3+5S=3K2SO4+2SO3+3N2, а выделяющиеся пары серного ангидрида конденсировали. Поглощая влагу, они превращались в олеум. В зависимости от способа приготовления H2SO4 называли купоросным маслом (oleum vitrioli) или серным маслом (oleum sulfuris). В 1595 г. алхимик Андреас Либавий (1550—1616) установил тождественность обоих веществ.
Долгое время купоросное масло не находило широкого применения. Интерес к нему сильно возрос после того, как в XVIII в. был открыт процесс получения из индиго индигокармина — устойчивого синего красителя. Первую фабрику по производству серной кислоты основали недалеко от Лондона в 1736 г. Процесс осуществляли в свинцовых камерах, на дно которых наливали воду. В верхней части камеры сжигали расплавленную смесь селитры с серой, затем туда запускали воздух. Процедуру повторяли до тех пор, пока на дне ёмкости не образовывалась кислота требуемой концентрации. При этом происходили следующие химические превращения:
S+О2=SO2 2KNO3+S=K2SO4+2NO
2NO+О2=2NO2 NO2+SO2+H2O=H2SO4+NO.
В XIX в. способ усовершенствовали: вместо селитры стали использовать азотную кислоту (она при разложении в камере даёт NO2). Чтобы возвращать в систему нитрозные газы были сконструированы специальные башни, которые и дали название всему процессу — башенный процесс. Заводы, работающие по башенному методу, существуют и в наше время.
Однако сейчас для производства серной кислоты применяют в основном контактный метод, разработанный в 1831 г. По этому методу окисление SO2 до SO3
(2SO2+О2 «2SO3) осуществляется на катализаторе — оксиде ванадия(V) V2O5.
Серная кислота образует два ряда солей — сульфаты (например, K2SO4) и гидросульфаты (KHSO4). Сульфаты многих металлов кристаллизуются из растворов в виде гидратов (например, гипс CaSO4•2Н2О), Гидратированные сульфаты меди (CuSO4•5Н2О), железа(И) (FeSO4•7Н2О) и цинка (ZnSO4•7Н2О) называют купоросами.
Качественной реакцией на серную кислоту и её соли служит образование белого осадка сульфата бария, нерастворимого в кислотах. Для проведения реакции используют раствор хлорида или нитрата бария, подкисленный соляной или азотной кислотой: ВаCl2+K2SO4=BaSO4¯+2КCl.
Серная кислота является одним из главных продуктов химической промышленности. Она применяется при производстве азотной кислоты и минеральных удобрений, моющих средств, в органическом синтезе при получении красителей, диэтилового эфира, этилацетата. В нефтяной промышленности серная кислота используется для очистки нефтепродуктов, в горнодобывающей — при переработке некоторых руд, в металлургии — для травления металлических поверхностей и очистки их от окалины. В лабораторной практике концентрированная серная кислота служит осушителем. В свинцовые аккумуляторы заливают 30—40-процентный раствор серной кислоты.
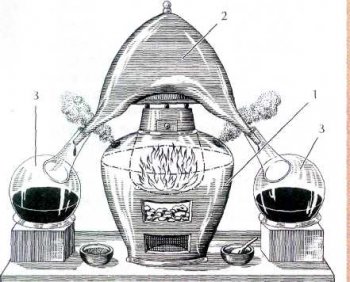
Установка для получения серной кислоты сжиганием серы в присутствии селитры.
Середина XVIII в. Приготовленную заранее смесь серы с селитрой загружают в печь (1), разогреваемую углями.
Образующиеся газы достигают стеклянного сосуда (2), где они взаимодействуют С парами воды. Получающийся при этом олеум собирают в колбы (3).
Минерал пирит FeS2 представляет собой дисульфид железа, соль слабой кислоты H2S2, построенной аналогично пероксиду водорода Н2О2.




Похожие статьи