Аминокислоты – это производные карбоновых кислот, в которых атом водорода в αположении замещён на амино (-NH2) группу. Аминокислоты, входящие в состав белков и пептидов (протеиногенные) имеют общее строение: 1) аминогруппа находится в α-положении относительно карбоксильной группы; 2) все протеиногенные аминокислоты являются стереоизомерами L-ряда
Классификация протеиногенных аминокислот
I. В зависимости от химического строения бокового радикала различают:
1. Ациклические аминокислоты, которые в свою очередь в зависимости от количества аминои карбоксильных групп делятся на: а) моноаминомонокарбоновые (например, глицин, валин и др.); б) моноаминодикарбоновые (аспарагиновая, глутаминовая кислоты); диаминомонокарбоновые (лизин, аргинин).
2. .Циклические аминокислоты, которые в зависимости от химического строения циклической структуры, делятся на: а) карбоциклические (фенилаланин, тирозин); б) гетероциклические: а) имеющие первичную аминогруппу в боковой цепи (триптофан, гистидин) и б) иминокислоты (пролин)
II.Рациональная классификация основывается на полярности и зарядах радикала R: а).Аминокислоты с неполярными (гидрофобными) R группами (аланин, триптофан, метионин и дргие); б) Аминокислоты с полярными (гидрофильными) R группами (глицин, серин, треонин, тирозин и др.); в) Аминокислоты с негативно заряженными R группами –кислые аминокислоты (аспарагиновая, глутаминовая кислоты); г) Аминокислоты с позитивно заряженными R группами – основные аминокислоты (лизин, гистидин, аргинин). Формулы см. учебник
Аминокислоты способны вступать в реакции полимеризации: одна аминокислота за счёт гидроксила –ОН своей карбоксильной группы соединяется с азотом аминогруппы другой аминокислоты. При этом образуется пептидная связь.
Если соединяются 2 аминокислоты, то образуются дипептиды, если 3 аминокислоты – трипептиды и т.д. Называются пептиды таким образом: 1) первой указывается аминокислота, которая имеет свободную -NH2 группу; 2) в названиях аминокислот, реагирующих своей карбоксильной группой, окончание «ин» меняется на «ил»; 3) аминокислота, сохраняющая свободную карбоксильную группу, своего окончания не меняет.
В белках имеются различные типы связей: Ковалентные связи: 1) пептидная связь; 2) дисульфидная (-S-S-) связь. Нековалентные связи: 1) водородные связи (>N-H...O=C<); 2) ионные связи; 3) дипольные связи; 4) электростатического притяжения; 5) гидрофобного взаимодействия; 6) Ван-дер-Ваальсовы силы
Классификация протеиногенных аминокислот
I. В зависимости от химического строения бокового радикала различают:
1. Ациклические аминокислоты, которые в свою очередь в зависимости от количества аминои карбоксильных групп делятся на: а) моноаминомонокарбоновые (например, глицин, валин и др.); б) моноаминодикарбоновые (аспарагиновая, глутаминовая кислоты); диаминомонокарбоновые (лизин, аргинин).
2. .Циклические аминокислоты, которые в зависимости от химического строения циклической структуры, делятся на: а) карбоциклические (фенилаланин, тирозин); б) гетероциклические: а) имеющие первичную аминогруппу в боковой цепи (триптофан, гистидин) и б) иминокислоты (пролин)
II.Рациональная классификация основывается на полярности и зарядах радикала R: а).Аминокислоты с неполярными (гидрофобными) R группами (аланин, триптофан, метионин и дргие); б) Аминокислоты с полярными (гидрофильными) R группами (глицин, серин, треонин, тирозин и др.); в) Аминокислоты с негативно заряженными R группами –кислые аминокислоты (аспарагиновая, глутаминовая кислоты); г) Аминокислоты с позитивно заряженными R группами – основные аминокислоты (лизин, гистидин, аргинин). Формулы см. учебник
Аминокислоты способны вступать в реакции полимеризации: одна аминокислота за счёт гидроксила –ОН своей карбоксильной группы соединяется с азотом аминогруппы другой аминокислоты. При этом образуется пептидная связь.
Если соединяются 2 аминокислоты, то образуются дипептиды, если 3 аминокислоты – трипептиды и т.д. Называются пептиды таким образом: 1) первой указывается аминокислота, которая имеет свободную -NH2 группу; 2) в названиях аминокислот, реагирующих своей карбоксильной группой, окончание «ин» меняется на «ил»; 3) аминокислота, сохраняющая свободную карбоксильную группу, своего окончания не меняет.
В белках имеются различные типы связей: Ковалентные связи: 1) пептидная связь; 2) дисульфидная (-S-S-) связь. Нековалентные связи: 1) водородные связи (>N-H...O=C<); 2) ионные связи; 3) дипольные связи; 4) электростатического притяжения; 5) гидрофобного взаимодействия; 6) Ван-дер-Ваальсовы силы
Авторское право на материал
Копирование материалов допускается только с указанием активной ссылки на статью!
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
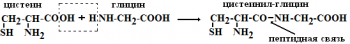
Похожие статьи