Ортофосфорная кислота является трёхосновной кислотой, средней силы по первой ступени и слабой по второй и третьей.
Всем этим трём анионам (РО43-, НРО42-, Н2РО4-) соответствуют различные соли — кислые, средние или основные.
При смешении растворов хлорида кальция и ортофосфата натрия (среда сильнощелочная в результате гидролиза соли) образуется осадок основного фосфата кальция — минерал апатит:
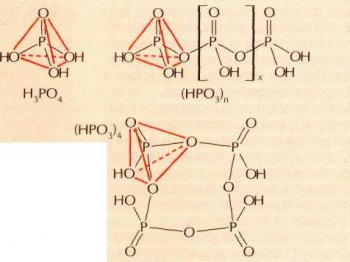
Строение ортофосфорной кислоты и метафосфорных кислот.
Оксид фосфора(IV) и фосфорную кислоту получил и исследовал немецкий химик Андреас Cuгизмунд Маргграф. Оксид фосфора (V) жадно поглощает воду, переходя в метафосфорную кислоту НРО3, — на этом основано его использование в качестве осушителя. Известно несколько метафосфорных кислот с обшей формулой (НРО3)x, где х=4 (тетраметафосфорная кислота), 6 (гексаметафосфорная кислота) или бесконечности (полиметафосфорные кислоты). При кипячении раствора метафосфорных кислот связи между отдельными фосфор-кислородными тетраэдрами разрываются, и метафосфорная кислота переходит в ортофосфорную кислоту H3PO4. В растворе для фосфорных кислот (в противоположность азотной кислоте) проявление окислительных свойств не характерно.
В теле человека массой 70 кг содержится около 780 г фосфора. В виде фосфатов кальция фосфор присутствует в костях человека и животных. Входит он и в состав белков, фосфолипидов, нуклеиновых кислот; соединения фосфора участвуют в энергетическом обмене (аденозинтрифосфорная кислота, АТФ). Ежедневная потребность человеческого организма в фосфоре составляет 1,2 г. Основное его количество мы потребляем с молоком и хлебом (в 100 г хлеба содержится примерно 200 мг фосфора). Наиболее богаты фосфором рыба (180 мг в 100 г продукта), фасоль (540 мг на 100 г продукта), некоторые виды сыра (до 600 мг на 100 г продукта). Интересно, что для правильного питания необходимо соблюдать баланс между количеством потребляемого фосфора и кальция: оптимальное соотношение этих элементов в пище составляет 1,5:1. Избыток богатой фосфором пиши приводит к вымыванию кальция из костей, а при избытке кальция развивается мочекаменная болезнь.
Зажигательная поверхность спичечного коробка покрыта смесью красного фосфора и порошка стекла. В состав спичечной головки входят окислители (PbO2, КСlО3, ВаСrO4) и восстановители (S, Sb2S3). При трении о зажигательную поверхность смесь, нанесённая на спичку, воспламеняется. Первые фосфорные спички — с головкой из белого фосфора — были созданы лишь в 1827 г. Такие спички загорались при трении о любую поверхность, что нередко приводило к пожарам. Кроме того, белый фосфор очень ядовит. Описаны случаи отравления фосфорными спичками как из-за неосторожного обращения, так и с целью самоубийства: для этого достаточно было съесть несколько спичечных головок. Вот почему на смену фосфорным спичкам пришли безопасные, которые верно служат нам и по сей день. Промышленное производство безопасных спичек началось в Швеции в 60-х гг. XIX в.
В старину для добычи селитры использовали солевые наросты, покрывавшие сырые стены каменных построек. В начале лета их соскребали, добавляли поташ и варили, а затем кристаллизовали. Из смеси нитратов аммония и кальция, содержащихся в этих наростах, образовывался нитрат калия — калийная селитра:
2NH4NO3+К2СО3®t°2KNO3+2NH3+СО2+Н2О
Ca(NO3)2+К2СО3 ®t°2KNO3+СаСО3.
Начиная с XV в. селитру стали получать из «селитряниц» — специальных ям, заполненных органическими отходами. Содержимое селитряниц, в которых образовывался нитрат аммония, подвергали варке с поташом.
Владимир Иванович Даль в «Толковом словаре живого великорусского языка» (1882 г.) даёт следующие толкования слов «селитра», «поташ» и связанных с ними понятий:
С азотной кислотой взаимодействуют практически все металлы разной химической активности (исключение составляют благородные металлы — платина, золото, рутений, родий, осмий и иридий). В отличие от других кислот, в реакциях HNO3 с металлами водород, как правило, не выделяется. Продуктами восстановления НNО3 являются оксиды азота в различных степенях окисления, свободный азот или ион аммония — в зависимости от активности металла. Состав этих продуктов определяется концентрацией кислоты (чем она выше, тем в меньшей степени протекает восстановление) и природой металла (чем активнее металл, тем полнее протекает восстановление кислоты). Следовательно, наиболее полного восстановления (до иона аммония) можно добиться, используя очень разбавленную, 1—3-процентную, азотную кислоту.
Некоторые металлы (железо, хром, алюминий) при комнатной температуре с концентрированной азотной кислотой не взаимодействуют: они пассивируются, так как на их поверхности образуется тонкая защитная плёнка соли. Даже барий, активно реагирующий с водой, может спокойно лежать на дне стакана с концентрированной азотной кислотой, поскольку покрывается коркой нитрата бария, практически нерастворимого в этой кислоте.