Не зная состава различных веществ, алхимики давали им произвольные названия, нередко очень длинные, неудобные для произношения и трудно запоминаемые. Одно и то же вещество могло иметь несколько имён. Например, к концу XVIII в. для сульфата меди существовало четыре названия, для карбоната меди — десять, для углекислого газа — двенадцать.
Некоторые названия химики ещё помнят, другие канули в Лету, и даже не всякий специалист по истории науки скажет, что такое «пригорело-древесная соль» (а это ацетат кальция, извлекаемый из продуктов сухой перегонки древесины) или «философская шерсть» (оксид цинка, который алхимики получали в виде рыхлого
Роль центрального атома в комплексе способен играть любой элемент. Чаще всего это переходные металлы, степень окисления которых может быть различной, даже отрицательной. Так, например, хром проявляет все степени окисления от —2 до +6: Na2[Cr(CO)5], Na2[Cr2(CO)10], Cr(CO)6, K3[Cr(CN)4], [Cr(NH3)6]Cl2, [Cr(H2O)6]Cl3, K2[CrF6], K3[СrО4], K2[СrО4].
Неметаллы, выступающие в качестве центральных атомов, тоже могут
иметь разную степень окисления. Так, кремний(IV) образует фторосиликат K2[SiF6]; хлор(0) — гидрат [Сl2•(Н2О)б], полученный ещё Фарадеем; иод, помещённый в раствор иодида калия, — комплекс К[I(I2)3], в котором центральный атом имеет степень окисления -1.
В качестве нейтральных лигандов чаще всего выступают СО, Н2О и NH3 (они входят в состав карбонилов, аквакомплексов и аммиакатов соответственно). Возможны и смешанно-лигандные комплексы, например [Cu(NH3)4(H2O)2]2+. Известно множество незаряженных органических лигандов: амины RNH2, фосфины R3P, ароматические соединения (бензол, пиридин) и т. д. Чаще же встречаются заряженные лиганды: галогениданионы, ОН-, CN-, NO2-, ONO- и т. д.
Такой «общей руководящей идеей» стала разработанная к 1893 г. швейцарским химиком Альфредом Вернером теория строения комплексных (или координационных) соединений.
Вернер разделил все неорганические вещества на так называемые соединения первого и высшего порядка. К соединениям первого порядка он отнёс главным образом достаточно простые по своей структуре вещества (Н2О, NaCl, PCl3). Соединениями высшего порядка учёный предложил считать продукты взаимодействия между собой соединений первого порядка — кристаллогидраты, аммиакаты, полисульфиды, двойные соли, а также комплексные соединения.
Комплексное соединение, по Вернеру, должно иметь в своей структуре центральный атом (ион), который равномерно окружён различными ионами или нейтральными молекулами, позднее их назвали лигандами (от лат. ligare — «связывать»). Число донорных атомов лигандов, непосредственно связанных с центральным атомом, называется его координационным числом.
В XIX в. в химии было накоплено большое число фактов, необъяснимых с точки зрения существовавшей тогда теории валентности. Многие вещества, в которых элементы, казалось бы, уже полностью использовали свои валентности, сохраняют способность к дальнейшему присоединению различных ионов и молекул. При этом новые, «незаконные» (с точки зрения теории) связи оказываются не менее прочными, чем «обычные» валентные связи. Некоторые из вновь открытых соединений были названы двойными солями (например, 3KF•AlF3), другие — аммиакатами (CuSO4•4NH3 третьи — кристаллогидратами (CuСl2•6Н2О) и т. д.
Необычность поведения подобных веществ можно продемонстрировать на примере соединений «четырёхвалентной» платины: PtCl4•2NH3, PtCl4•4NH3, PtCl4•6NH3 и PtCl4•2KCl. Несмотря на внешнее сходство, они резко различаются по свойствам. Так, первое из них в растворе практически не распадается на ионы (раствор не проводит электрический ток). Отсутствие хлорид-ионов подтверждает и качественная реакция: при взаимодействии раствора с нитратом серебра осадка AgCl не выпадает.
В начале XVIII в. красильный мастер Дисбах в Берлине приобрёл у торговца необычный поташ (карбонат калия), растворы которого с солями железа давали синее окрашивание. Оказалось, что поташ был ранее прокалён с бычьей кровью. Так открыли новую краску, названную берлинской лазурью. Но лишь гораздо позднее стало понятно, какие же химические процессы приводят к её образованию. Животные остатки, в том числе и кровь, содержат азот и серу. Карбонат калия прокаливали с сухой кровью в больших чугунных сосудах, в которые специально добавляли железные опилки или стружки. В этих условиях карбонат частично превращается в цианид KCN, а сера даёт с железом сульфид FeS. При обработке смеси горячей водой идёт реакция 6KCN + + FeS=K4[Fe(CN)6]+K2S. Её продукты — сульфид калия и соединение, которое в своё время назвали жёлтой кровяной солью (химическое название — гексацианоферрат(П) калия). А слово «цианид» происходит от греческого «кианос» — лазурный.
При взаимодействии жёлтой кровяной соли с солями железа(III) и образуется берлинская лазурь. Состав растворимой формы краски отвечает формуле K[Fe3+Fe2+(CN)6], а нерастворимой — Fe4[Fe(CN)6]3.
С—Н-кислотами называют органические вещества, в которых атомы водорода, связанные с атомом углерода, способны замешаться на металл. Например, заметные «кислотные» свойства проявляют углеводороды с тройной связью — ацетилен (С2Н2) и его производные. Так, ацетилен взаимодействует с металлическим натрием с образованием белого порошка аиетиленида натрия:
2СН=СН+2Na®2Н—СºС—Na+Н2.
Ещё более сильной С—Н-кислотой является трифенилметан (С6Н5)3СН — он реагирует даже с водным раствором щёлочи. Самая сильная из известных С—Н-кислот — цианпроизводное фуллерена: это примерно в 100 раз более сильная кислота, чем уксусная.
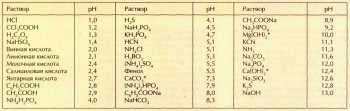
Интересно сравнить кислотность (щёлочность) растворов различных кислот, оснований и солей. Значение рН зависит от концентрации. Поэтому в таблице приведены значения рН водных растворов при концентрации 0,1 моль/л. Для малорастворимых соединений, отмеченных звёздочкой, указаны рН насыщенных растворов. Получается, что если выпить концентрированный лимонный сок, кислотность желудочного сока... понизится! Действительно, раствор лимонной кислоты лишь разбавит более сильную соляную кислоту, содержащуюся в желудочном соке.
Для характеристики кислотности среды вводят водородный показатель рН, который равен взятому с обратным знаком десятичному логарифму молярной концентрации ионов водорода: pH=-lg[H+].
В зависимости от концентрации ионов Н+ в растворе может быть кислая, нейтральная или щелочная среда. Дистиллированную воду, взятую при температуре 22 °С, принято считать нейтральной. Являясь слабым электролитом, вода частично диссоциирует на ионы Н+ (в водных растворах он всегда гидратирован и присутствует в виде Н3О+) и ОН-. Их концентрации одинаковы и составляют при комнатной температуре 10-7 моль/л.
Несложно рассчитать, что для нейтрального раствора (дистиллированной воды) рН=-lg(10-7)=7. Если значение водородного показателя меньше 7, раствор является кислым, так как концентрация ионов водорода в нём выше концентрации гидроксид-ионов. Например, раствор соляной кислоты с концентрацией 1 моль/л имеет pH=-lg(1)=0.
Каждому школьнику хорошо знаком лакмус — с его помощью определяют кислотность среды. Это вещество является кислотно-основным индикатором, т. е. обладает способностью обратимо изменять окраску в зависимости от кислотности раствора: в кислой среде лакмус становится красным, а в щелочной — синим. В нейтральной среде цвет лакмуса фиолетовый — это сочетание равных количеств синего и красного. Хотя лакмус уже в течение нескольких столетий верно служит людям, его состав так до конца и не изучен. В этом нет ничего удивительного: ведь лакмус — это сложная смесь природных соединений. Он был известен уже в Древнем Египте и в Древнем Риме, где его использовали в качестве фиолетовой краски — заменителя дорогостоящего пурпура. Затем рецепт приготовления лакмуса оказался утерян. Лишь в начале XIV в. во Флоренции вновь была открыта фиолетовая краска орсейль, тождественная лакмусу, причём способ её приготовления в течение многих лет держали в секрете.